解答题-工业流程题 适中0.65 引用1 组卷158
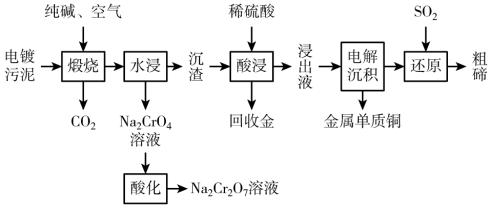
某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如图:
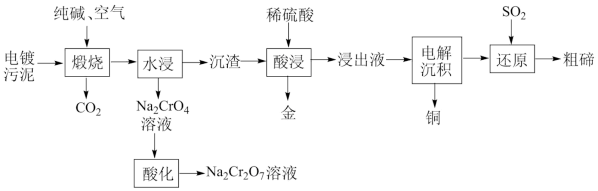
已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2=2CuO+TeO2
(1)Te元素在元素周期表中的位置为___ 。
(2)煅烧时,Cr2O3发生反应的化学方程式为___ 。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有___ (填化学式)。电解沉积过程中析出单质铜的电极为__ 极。
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
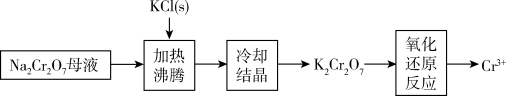
通过冷却结晶能析出大量K2Cr2O7的原因是___ 。
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.5g配成250mL溶液,取25.00mL置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol/L(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为___ 。若三次实验消耗(NH4)2Fe(SO4)2标准液的体积平均为25.00mL,则所得产品中K2Cr2O7的纯度为___ (保留三位有效数字)。

已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2=2CuO+TeO2
(1)Te元素在元素周期表中的位置为
(2)煅烧时,Cr2O3发生反应的化学方程式为
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:

通过冷却结晶能析出大量K2Cr2O7的原因是
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.5g配成250mL溶液,取25.00mL置于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol/L(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为
20-21高三下·广东深圳·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网