解答题-原理综合题 适中0.65 引用1 组卷58
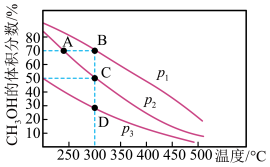
文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)。将HCl和O2分别以5种物质的量比:①1∶1 ②2∶1 ③4∶1 ④6∶1 ⑤8∶1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图。

(1)可以判断该反应已经达到化学平衡的是___________ 
 填字母
填字母 。
。
A.密闭容器中总压强不变 B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2) D.密闭容器中氯气的体积分数不变
(2)d曲线对应的投料比是___________  填比值,从题干中选择,下同
填比值,从题干中选择,下同 有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl) ∶n(O2)=
有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl) ∶n(O2)=___________ 制备。
(3)该反应的平衡常数表达式为___________ 。
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为___________ 。
(5)已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
CH3OH(g)+ O2(g)═CO2(g)+2H2(g)△H=-182.9kJ•mol-1则 CO(g)+2H2(g)═CH3OH(g)△H=
O2(g)═CO2(g)+2H2(g)△H=-182.9kJ•mol-1则 CO(g)+2H2(g)═CH3OH(g)△H= ___________ kJ·mol-1。

(1)可以判断该反应已经达到化学平衡的是
A.密闭容器中总压强不变 B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2) D.密闭容器中氯气的体积分数不变
(2)d曲线对应的投料比是
(3)该反应的平衡常数表达式为
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为
(5)已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
CH3OH(g)+
20-21高二下·江苏无锡·阶段练习
类题推荐
合成气是重要的有机合成原料,主要组分为CO和H2。工业上常用天然气为主要原料通过湿法重整或干法重整制备合成气,反应原理如下:
(1)∆H4=___ 。
(2)800℃时,向体积为2L的恒容密闭容器中通入2molCH4(g)和3molCO2(g)进行干法重整。5min时达到平衡,此时容器中CH4(g)的体积分数为25%。
①能说明上述反应达到平衡状态的是__ (填选项字母)。
A.容器内气体密度保持不变
B.CO与H2的物质的量之比保持不变
C.混合气体的平均相对分子质量不再变化
D.CH4与H2的生成速率之比为1:2
②0~5min内,v(CO)=__ ;该反应的平衡常数K=___ 。
(3)若按照n(CH4):n(H2O)=1:3投料进行湿法重整,相同压强下,实验测定CH4(g)平衡转化率和CO2(g)平衡产率随温度的变化关系如图所示。

图中表示CH4(g)平衡转化率的曲线是__ ;T1温度前后,曲线b先升高后降低的原因为__ 。
| 方法 | 原理 |
| 湿法重整 | i.CH4(g)+H2O(g) |
| ii.CH4(g)+H2O(g) | |
| iii.CH(g)+H2O(g) | |
| 干法重整 | CH4(g)+CO(g) |
(2)800℃时,向体积为2L的恒容密闭容器中通入2molCH4(g)和3molCO2(g)进行干法重整。5min时达到平衡,此时容器中CH4(g)的体积分数为25%。
①能说明上述反应达到平衡状态的是
A.容器内气体密度保持不变
B.CO与H2的物质的量之比保持不变
C.混合气体的平均相对分子质量不再变化
D.CH4与H2的生成速率之比为1:2
②0~5min内,v(CO)=
(3)若按照n(CH4):n(H2O)=1:3投料进行湿法重整,相同压强下,实验测定CH4(g)平衡转化率和CO2(g)平衡产率随温度的变化关系如图所示。

图中表示CH4(g)平衡转化率的曲线是
I.食醋是食物调味品之一,食醋中的乙酸也可以用于制氢,已知可以发生如下反应:
热裂解反应CH3COOH(g) 2CO(g)+2H2(g) △H=+2l3.7kJ·mol-1
2CO(g)+2H2(g) △H=+2l3.7kJ·mol-1
脱羧基反应CH3COOH(g) CH4(g)+CO2(g) △H=-33.5kJ·mol-1
CH4(g)+CO2(g) △H=-33.5kJ·mol-1
合成乙酸反应CH3OH(g)+CO(g)→CH3COOH(g) △H=-123.7kJ·mol-1
(1)请写出CO与H2甲醇化的热化学方程式___ 。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为___ 。
II.工业上可用乙酸热裂解生成的CO和H2制备CH3OH,CH3OH也是重要的溶剂和替代燃料。
(3)某温度下,在一恒压容器中分别充入0.7molCO和0.5molCH3OH(g),达到平衡时容器体积为2L,且含有0.2molH2(g),则用CO和H2制备CH3OH平衡常数的值为___ ,此时向容器中再通入0.4molCO气体和0.2molCH3OH(g),则此平衡将___ 。(填“向正向移动”、“不移动”或“向逆向移动”)
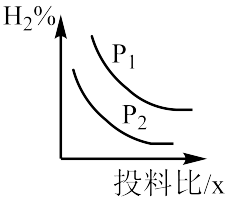
(4)对于CO和H2制备CH3OH的反应,若容器压强、CO与H2投料比x对反应的影响如图所示,则图中曲线所示的压强关系:p1___ p2(填“=”“>”或“<”),其判断理由是___ 。
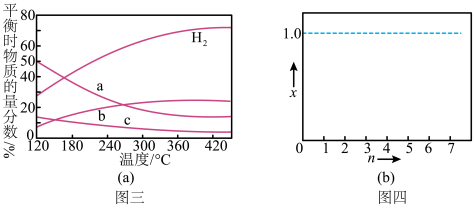
(5)现有容积均为1L的a、b、c三个密闭容器,往其中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b中甲醇体积分数大于a中的原因是___ ;达到平衡时,a、b、c中CO的转化率大小关系为___ 。

热裂解反应CH3COOH(g)
脱羧基反应CH3COOH(g)
合成乙酸反应CH3OH(g)+CO(g)→CH3COOH(g) △H=-123.7kJ·mol-1
(1)请写出CO与H2甲醇化的热化学方程式
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为
| A.较低温度 | B.较大压强 | C.高温 | D.低压 |
II.工业上可用乙酸热裂解生成的CO和H2制备CH3OH,CH3OH也是重要的溶剂和替代燃料。
(3)某温度下,在一恒压容器中分别充入0.7molCO和0.5molCH3OH(g),达到平衡时容器体积为2L,且含有0.2molH2(g),则用CO和H2制备CH3OH平衡常数的值为
(4)对于CO和H2制备CH3OH的反应,若容器压强、CO与H2投料比x对反应的影响如图所示,则图中曲线所示的压强关系:p1

(5)现有容积均为1L的a、b、c三个密闭容器,往其中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b中甲醇体积分数大于a中的原因是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网