解答题-实验探究题 适中0.65 引用1 组卷114
乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1) 室温下,测得 0.1 mol·L−1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式_______ 。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图所示:
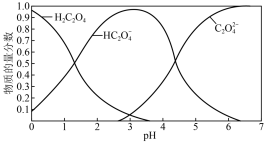
向草酸溶液中滴加KOH溶液至pH = 3时发生的主要反应的离子方程式是_______ 。
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4 + xH2O⇌FeC2O4 xH2O↓ + 2H+
xH2O↓ + 2H+
①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:________________ 。
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:
称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。
已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+
则滴定实验应选用______ (填写酸式或碱式)滴定管,通过计算FeC2O4·xH2O中x的值。(FeC2O4的摩尔质量是144 g·mol-1)__________ 。(写出计算过程)
(1) 室温下,测得 0.1 mol·L−1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图所示:

向草酸溶液中滴加KOH溶液至pH = 3时发生的主要反应的离子方程式是
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4 + xH2O⇌FeC2O4
①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:
称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。
已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+
则滴定实验应选用
20-21高二下·江苏无锡·期中
类题推荐
乙酸、碳酸、次氯酸、草酸在生产、生活及医药方面有广泛用途。回答下列问题:
I.已知25℃时,部分物质的电离常数如表所示:
(1)a.CH3COOH、b.H2CO3、c.HClO的酸性由强到弱的顺序为_______ (填编号)。
(2)水存在如下平衡:H2O+H2O⇌H3O++OH-ΔH>0,现欲使平衡向右移动,结果使溶液显碱性,应选择方法_______ 。
A.向水中加入NaHSO4固体 B.向水中加入NaOH固体 C.加热至100℃ D.向水中加入Na
(3)NaClO溶液显碱性的原因(用化学用语表示)_______ 。
(4)向NaClO溶液中通入少量的CO2,反应的离子方程式为_______ 。
(5)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系_______ 。
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(6)25℃时,有两种溶液:①0.10mol·L-1CH3COOH溶液,②Na2CO3溶液,下列说法正确的是_______ (填字母)。
A.CH3COOH和Na2CO3都属于强电解质
B.①中:c(CH3COOH)+c(CH3COO-) = 0.10mol·L-1
C.②中:c(Na+)>c(OH-)>c(CO ) > c(HCO
) > c(HCO )>c(H+)
)>c(H+)
II.乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1)室温下,测得0.1 mol·L-1 H2C2O4溶液的pH =1.3,写出草酸的电离方程式_______ 。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
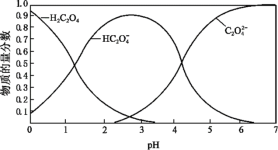
①向草酸溶液中滴加KOH溶液至pH=2.5时发生的主要反应的离子方程式是_______ 。
②0.1 mol·L-1 KHC2O4溶液中,下列粒子浓度关系正确的是_______ (填序号)。
a.c(K+)+c(H+)=c(HC2O )+c(C2O
)+c(C2O )+c(OH-)
)+c(OH-)
b.c(K+)>c(HC2O ) > c(C2O
) > c(C2O ) > c(H2C2O4)
) > c(H2C2O4)
c.c(K+)=c(HC2O ) + c(C2O
) + c(C2O )+c(H2C2O4)
)+c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4+xH2O FeC2O4·xH2O↓+2H+
FeC2O4·xH2O↓+2H+
①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_______ 。
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+,则FeC2O4·xH2O中x=_______ (FeC2O4的摩尔质量是144 g·mol-1)。
I.已知25℃时,部分物质的电离常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(2)水存在如下平衡:H2O+H2O⇌H3O++OH-ΔH>0,现欲使平衡向右移动,结果使溶液显碱性,应选择方法
A.向水中加入NaHSO4固体 B.向水中加入NaOH固体 C.加热至100℃ D.向水中加入Na
(3)NaClO溶液显碱性的原因(用化学用语表示)
(4)向NaClO溶液中通入少量的CO2,反应的离子方程式为
(5)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(6)25℃时,有两种溶液:①0.10mol·L-1CH3COOH溶液,②Na2CO3溶液,下列说法正确的是
A.CH3COOH和Na2CO3都属于强电解质
B.①中:c(CH3COOH)+c(CH3COO-) = 0.10mol·L-1
C.②中:c(Na+)>c(OH-)>c(CO
II.乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1)室温下,测得0.1 mol·L-1 H2C2O4溶液的pH =1.3,写出草酸的电离方程式
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:

①向草酸溶液中滴加KOH溶液至pH=2.5时发生的主要反应的离子方程式是
②0.1 mol·L-1 KHC2O4溶液中,下列粒子浓度关系正确的是
a.c(K+)+c(H+)=c(HC2O
b.c(K+)>c(HC2O
c.c(K+)=c(HC2O
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4+xH2O
①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+,则FeC2O4·xH2O中x=
向某草酸溶液中滴加KOH溶液,溶液中 、
、 、
、 的物质的量浓度分数δ(X)[
的物质的量浓度分数δ(X)[ ]与pH的关系如图所示:
]与pH的关系如图所示:
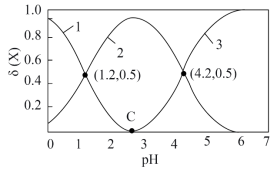
请回答下列问题:
(1)室温下,草酸的一级电离常数 为
为_______ ;
(2)①向草酸溶液中滴加KOH溶液至 的过程中主要反应的离子方程式为
的过程中主要反应的离子方程式为_______ 。
②0.1 moL
 溶液中,
溶液中,
_______  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
(3)室温下,通过下列实验探究0.0100 mol⋅L
 溶液的性质:
溶液的性质:
实验1:实验测得0.0100 mol⋅L
 溶液的pH为8.6。
溶液的pH为8.6。
实验2:向溶液中滴加等体积、0.0100 mol⋅L HCl溶液。pH由8.6降为4.8。
HCl溶液。pH由8.6降为4.8。
实验3:向溶液中加入等体积0.0200 mol⋅L
 溶液,出现白色沉淀。
溶液,出现白色沉淀。
实验4:向稀硫酸酸化的 ,溶液中滴加
,溶液中滴加 溶液至溶液褪色。
溶液至溶液褪色。
已知室温下 ,下列说法错误的是_______;
,下列说法错误的是_______;
(4)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为: 。
。
①制备时需添加氨水以提高 的产率,从化学平衡移动角度解释原因
的产率,从化学平衡移动角度解释原因_______ :
②测定草酸亚铁晶体( )的x值,实验如下:
)的x值,实验如下:
称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性 溶液漓定。到达滴定终点时,消耗0.1000 mol·L
溶液漓定。到达滴定终点时,消耗0.1000 mol·L 的酸性
的酸性 溶液18.00 mL。
溶液18.00 mL。
则 中
中
_______ ( 的摩尔质量是144 g⋅mol
的摩尔质量是144 g⋅mol )。
)。

请回答下列问题:
(1)室温下,草酸的一级电离常数
(2)①向草酸溶液中滴加KOH溶液至
②0.1 moL
(3)室温下,通过下列实验探究0.0100 mol⋅L
实验1:实验测得0.0100 mol⋅L
实验2:向溶液中滴加等体积、0.0100 mol⋅L
实验3:向溶液中加入等体积0.0200 mol⋅L
实验4:向稀硫酸酸化的
已知室温下
| A.0.0100 mol⋅L |
| B.实验2滴加盐酸过程中不可能存在: |
| C.实验3所得上层清液中: |
| D.实验4发生反应的离子方程式为 |
①制备时需添加氨水以提高
②测定草酸亚铁晶体(
称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性
则
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网