解答题-原理综合题 适中0.65 引用1 组卷51
氮的化合物在工业中应用十分广泛。
(1)工业上尿素【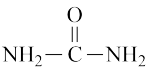 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=___
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
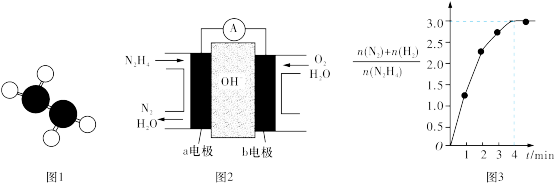
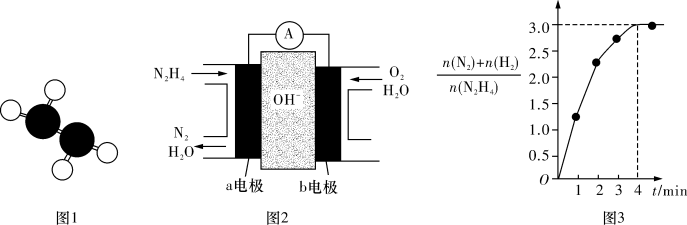
①已知肼的球棍模型如图1所示,试写出肼的电子式:_______ 。
②目前正在研发的一种肼燃料电池的结构如图2所示,_____ (填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=________ 。
(1)工业上尿素【
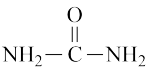 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。

①已知肼的球棍模型如图1所示,试写出肼的电子式:
②目前正在研发的一种肼燃料电池的结构如图2所示,
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=
20-21高一下·江西景德镇·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
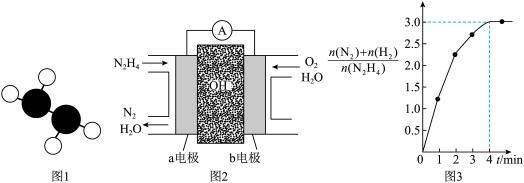
 N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=
N2(g)+2H2(g),测得容器中的与时间的关系如图3所示,则 0~4 min内氮气的平均反应速率v(N2)=