解答题-原理综合题 较难0.4 引用1 组卷467
CO2的综合利用是当前研究的热点问题。2020年12月24日,中国科学院大气物理研究所碳中和研究中心(等)在北京挂牌成立。回答下列问题:
(1)已知:I.C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-l;
Ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ·mol-l;
Ⅲ.C(s)+2H2(g)=CH4(g) ΔH3=-74.8kJ·mol-1。
利用光能和光催化剂,将CO2(g)和H2O(g)转化为CH4(g)和O2(g)的热化学方程式为_______ 。
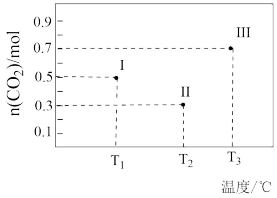
(2)一定温度下,将1molCH4(g)和3molCO2(g)充入起始压强为4MPa、体积为10L的恒容密闭容器中,一定条件下发生反应CH4(g)+CO2(g) ⇌2CO(g)+2H2(g) ΔH=+247kJ·mol-1。
①下列事实可以判定反应达到平衡状态的是_______ (填选项字母)。
A. 为定值
为定值
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
②若上述反应10min末达到平衡,容器内的压强变为起始压强的1.25倍,则0~10min内,用CO2的浓度变化表示的平均反应速率v(CO2)=_______ ;CH4的平衡转化率为_______ ;该反应的平衡常数Kp=_______ MPa2(用平衡分压代替平衡浓度表示的平衡常数,分压=总压×该物质的物质的量分数)。
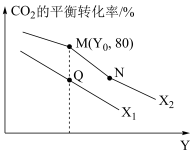
(3)一定条件下,CO2催化加氢可以合成乙醇:2CO2(g)+6H2(g) ⇌C2H5OH(g)+3H2O(g)。向I、Ⅱ、Ⅲ三个容积均为1L的恒容密闭容器中均充入1molCO2(g)和3molH2(g),在不同温度下发生上述反应。反应5min,测得各容器内CO2的物质的量如图所示:
①该反应的ΔH_______ 0(填“>”或“<”)。
②5min后,向容器Ⅲ中再充入1molCO2(g)和1molH2O(g),此时v逆_______ v正(填“>”“<”或“=”)。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。通过人工光合作用制备HCOOH的原理示意图如图所示:
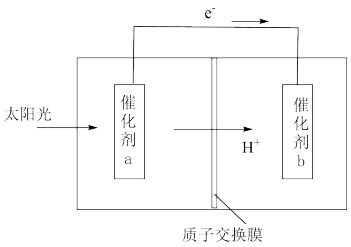
催化剂a表面发生____ (填“氧化”或“还原”)反应;催化剂b表面的电极反应式为___ 。
(1)已知:I.C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-l;
Ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ·mol-l;
Ⅲ.C(s)+2H2(g)=CH4(g) ΔH3=-74.8kJ·mol-1。
利用光能和光催化剂,将CO2(g)和H2O(g)转化为CH4(g)和O2(g)的热化学方程式为
(2)一定温度下,将1molCH4(g)和3molCO2(g)充入起始压强为4MPa、体积为10L的恒容密闭容器中,一定条件下发生反应CH4(g)+CO2(g) ⇌2CO(g)+2H2(g) ΔH=+247kJ·mol-1。
①下列事实可以判定反应达到平衡状态的是
A.
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
②若上述反应10min末达到平衡,容器内的压强变为起始压强的1.25倍,则0~10min内,用CO2的浓度变化表示的平均反应速率v(CO2)=
(3)一定条件下,CO2催化加氢可以合成乙醇:2CO2(g)+6H2(g) ⇌C2H5OH(g)+3H2O(g)。向I、Ⅱ、Ⅲ三个容积均为1L的恒容密闭容器中均充入1molCO2(g)和3molH2(g),在不同温度下发生上述反应。反应5min,测得各容器内CO2的物质的量如图所示:

①该反应的ΔH
②5min后,向容器Ⅲ中再充入1molCO2(g)和1molH2O(g),此时v逆
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。通过人工光合作用制备HCOOH的原理示意图如图所示:

催化剂a表面发生
2021·四川成都·模拟预测
类题推荐
在工业上,常用CO和H2合成甲醇,其相关的反应原理方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知:①CO(g)+ O2(g)= CO2(g) △H1= a kJ/mol
O2(g)= CO2(g) △H1= a kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2= b kJ/mol
O2(g)=H2O(g) △H2= b kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
O2(g)=CO2(g)+ 2H2O(g) △H3= c kJ/mol
回答下列问题:
(1)△H=___________ kJ/mol 。
(2)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。

①当起始 =2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)
=2,经过5min达到平衡,CO的转化率为60%,则0~5min内平均反应速率v(H2)___________ 。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将___________ (选填“增大”、“减小”或“不变”);
②当起始 =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________ 点(选填“D”、“E”或“F”) 。
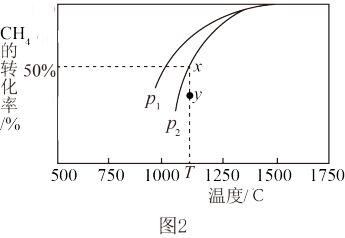
(4)已知CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强P1___________ P2(选填“>” “<” 或“=”);当压强为P2时,在y点:v(正)___________ v(逆)(选填“大于”、“小于”或“等于”)。若P2=3MPa且在恒压体系中发生,则T℃时该反应的平衡常数Kp = ___________ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
已知:①CO(g)+
②H2(g)+
③CH3OH(g)+
回答下列问题:
(1)△H=
(2)能说明反应CO(g)+2H2(g)
| A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |

①当起始
②当起始
(4)已知CO2(g)+CH4(g)

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网