计算题 较难0.4 引用1 组卷458
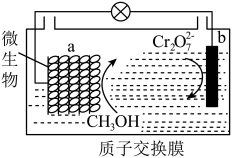
化学工业中会产生大量含铬废水。需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法:向酸性废水中加入NaHSO3使Cr2O 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
①写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___________ 。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于1×10-5mol·L-1,此时溶液中的c(H+)<___________ mol·L-1
(2)废水中铬元素总浓度的测定方法:向一定量含Cr2O 和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O
和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O ,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O
,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O 与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+
与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+ Cr2O
Cr2O
 I2
I2 S4O
S4O 。
。
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会___________ (填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O 和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。
和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。___________
(1)工业常用NaHSO3还原法处理,方法:向酸性废水中加入NaHSO3使Cr2O
①写出NaHSO3与Cr2O
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于1×10-5mol·L-1,此时溶液中的c(H+)<
(2)废水中铬元素总浓度的测定方法:向一定量含Cr2O
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会
②准确移取含Cr2O
20-21高三上·江苏苏州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网