解答题-结构与性质 0.4 引用1 组卷81
翡翠是一类名贵的装饰品,其主要成分为硅酸铝钠(NaAlSi2O6),常含微量Cr、Ni、Mn等元素。回答下列问题:
(1)基态硅原子的电子排布式为__ ;基态铬原子的价电子排布图不能写成 形式,其原因是违背了
形式,其原因是违背了___ 。
(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为___ (填元素符号),灼烧硅酸铝钠时,当钠元素的价电子由__ (填“激发态”或“基态”)跃迁到另一状态时产生黄色火焰。
(3)工业上冶炼金属铝的方程式为__ 。硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子为sp3杂化的有___ ;分子空间构型属于正四面体的是__ 。
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:___ 。
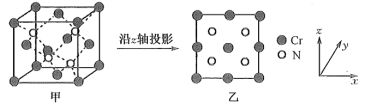
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为__ 。知该晶体密度为ρg·cm-3。晶体中Cr原子和N的最近核间距为___ pm(NA表示阿伏加德罗常数值)。
(1)基态硅原子的电子排布式为
 形式,其原因是违背了
形式,其原因是违背了(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为
(3)工业上冶炼金属铝的方程式为
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为

20-21高三·天津·阶段练习


