解答题-结构与性质 适中0.65 引用4 组卷420
高熵合金通常被定义为含有5种以上主要元素的固溶体,每种元素的摩尔比为 。这个概念已经扩展到创造熵稳定的功能材料中。此类材料有熵稳定高熵功能材料(
。这个概念已经扩展到创造熵稳定的功能材料中。此类材料有熵稳定高熵功能材料( 的氧化物),以及尖晶石、碳化物和硅化物等。根据所学知识回答下列问题:
的氧化物),以及尖晶石、碳化物和硅化物等。根据所学知识回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ ,有_______ 个未成对电子。
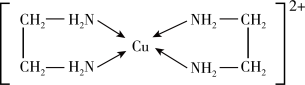
(2)镍及其化合物常用作有机合成的催化剂,如 (
( 表示苯基),在该化合物中,配体的空间构型为
表示苯基),在该化合物中,配体的空间构型为_______ ; 晶体中存在的化学键类型有
晶体中存在的化学键类型有_______ (填标号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(3)尖晶石是镁铝氧化物组成的矿物,含有铁、锌、锰等元素。 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为_______ 。
(4)已知: 是强还原剂,与水反应能生成
是强还原剂,与水反应能生成 ,
, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为_______ ,该离子中C的杂化方式为_______ 。
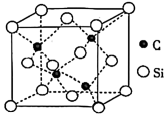
(5) 的晶胞结构如图所示,若碳和硅的原子半径分别为
的晶胞结构如图所示,若碳和硅的原子半径分别为 和
和 ,密度为
,密度为 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为
,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为_______ (用含 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)基态
(2)镍及其化合物常用作有机合成的催化剂,如
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(3)尖晶石是镁铝氧化物组成的矿物,含有铁、锌、锰等元素。
(4)已知:
(5)

2021·河北沧州·三模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网