解答题-工业流程题 适中0.65 引用1 组卷56
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。工业上利用铬铁矿[主要成分为Fe(CrO2)2]制三氯化铬的流程如下:
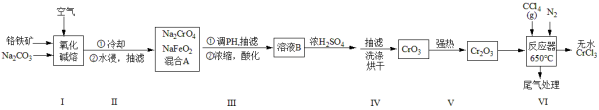
已知:CrO3为暗红色或暗紫色斜方结晶体,易潮解,易溶于水、乙醇、乙醚,具有强氧化性。请回答:
(1)步骤I氧化碱熔所需要的主要仪器可选择___________ 。
A.石英坩埚 B.铁坩埚 C.氧化铝坩埚 D.瓷坩埚
(2)步骤I中的化学方程式___________ 。
(3)步骤IV洗涤CrO3晶体时,最合适的洗涤剂是___________ 。
A.乙醇 B.浓盐酸 C.浓硝酸 B.浓硫酸
(4)在该制备流程中多次用到了抽滤操作,下列关于抽滤说法不正确的是___________ 。
A.步骤IV抽滤时可选用滤纸,其大小应略小于布氏漏斗内径但又能将全部小孔盖住
B.抽滤操作在连接仪器时应将橡胶塞用力压入吸滤瓶,但橡胶塞插入吸滤瓶内的部分不得超过塞子高度的
C.洗涤沉淀时应关小水龙头,使洗涤剂缓慢通过沉淀物
D.洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做烘干处理
(5)三氯化铬纯度的测定:准确称量0.1000g样品于锥形瓶中,加适量的2mol·L-1NaOH溶液,小火加热20min,使其完全转变成绿色沉淀Cr(OH)3。冷却后加足量的30%H2O2,小火加热至绿色沉淀完全溶解,继续加热一段时间。冷却后酸化,再用0.1000mol·L-1的硫酸亚铁铵溶液滴定至终点,共消耗硫酸亚铁铵溶液12.00mL。已知:2Cr(OH)3+3H2O2+4OH-=2CrO +8H2O。试回答:
+8H2O。试回答:
绿色沉淀完全溶解后继续加热一段时间的目的是___________ 。

已知:CrO3为暗红色或暗紫色斜方结晶体,易潮解,易溶于水、乙醇、乙醚,具有强氧化性。请回答:
(1)步骤I氧化碱熔所需要的主要仪器可选择
A.石英坩埚 B.铁坩埚 C.氧化铝坩埚 D.瓷坩埚
(2)步骤I中的化学方程式
(3)步骤IV洗涤CrO3晶体时,最合适的洗涤剂是
A.乙醇 B.浓盐酸 C.浓硝酸 B.浓硫酸
(4)在该制备流程中多次用到了抽滤操作,下列关于抽滤说法不正确的是
A.步骤IV抽滤时可选用滤纸,其大小应略小于布氏漏斗内径但又能将全部小孔盖住
B.抽滤操作在连接仪器时应将橡胶塞用力压入吸滤瓶,但橡胶塞插入吸滤瓶内的部分不得超过塞子高度的
C.洗涤沉淀时应关小水龙头,使洗涤剂缓慢通过沉淀物
D.洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做烘干处理
(5)三氯化铬纯度的测定:准确称量0.1000g样品于锥形瓶中,加适量的2mol·L-1NaOH溶液,小火加热20min,使其完全转变成绿色沉淀Cr(OH)3。冷却后加足量的30%H2O2,小火加热至绿色沉淀完全溶解,继续加热一段时间。冷却后酸化,再用0.1000mol·L-1的硫酸亚铁铵溶液滴定至终点,共消耗硫酸亚铁铵溶液12.00mL。已知:2Cr(OH)3+3H2O2+4OH-=2CrO
绿色沉淀完全溶解后继续加热一段时间的目的是
20-21高二下·浙江·阶段练习
类题推荐
1,6-己二酸是常用的化工原料,实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为原料制备1,6-己二酸。反应原理为:
 +2HNO3
+2HNO3
 +2NO2↑+2H2O
+2NO2↑+2H2O
 +6HNO3
+6HNO3 HOOC(CH2)4COOH+6O2↑+3H2O
HOOC(CH2)4COOH+6O2↑+3H2O

相关物质的物理性质见表:
实验步骤如下:
I.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇。
II.将三颈烧瓶放入水浴中,磁力搅拌并加热至50℃;移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇,调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕。
III.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100L烧杯中,冷却至室温后,有白色晶体析出,减压过滤,____,干燥,得到粗产品。
IV.1,6-己二酸粗产品的提纯。
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为____ (填字母)。
(2)仪器A的名称为____ ,其作用是____ 。
(3)若步骤II中控制水浴温度不当,未滴加环己醇前就会观察到有红棕色气体生成,原因为____ 。滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应的△H____ (填“>”或“<”)0。
(4)实验中用到的减压过滤装置如图所示,下列操作不正确的是____ 。

(5)将步骤III补充完整:____ 。步骤IV提纯方法的名称为____ 。
(6)下列说法不正确的是____ 。
 +2HNO3
+2HNO3 +2NO2↑+2H2O
+2NO2↑+2H2O +6HNO3
+6HNO3
相关物质的物理性质见表:
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 溶解性 |
| 环己醇 | 100 | 0.962 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 微溶于冷水,溶于热水 |
I.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇。
II.将三颈烧瓶放入水浴中,磁力搅拌并加热至50℃;移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇,调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕。
III.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100L烧杯中,冷却至室温后,有白色晶体析出,减压过滤,____,干燥,得到粗产品。
IV.1,6-己二酸粗产品的提纯。
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为
| A.50mL | B.100mL | C.500mL | D.1000mL |
(3)若步骤II中控制水浴温度不当,未滴加环己醇前就会观察到有红棕色气体生成,原因为
(4)实验中用到的减压过滤装置如图所示,下列操作不正确的是

| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
(6)下列说法不正确的是
| A.反应完成后,倒反应液时要在通风橱中进行 |
| B.反应时,温度计水银球应置于三颈烧瓶中液面以下 |
| C.装置B中发生非氧化还原反应 |
| D.常用质谱法进行1,6-己二酸相对分子质量的测定 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网