解答题-实验探究题 适中0.65 引用1 组卷333
某兴趣小组利用葡萄糖酸钙[Ca(C6H11O7)2]与硫酸锌反应制备葡萄糖酸锌[Zn(C6H11O7)2]的流程为:
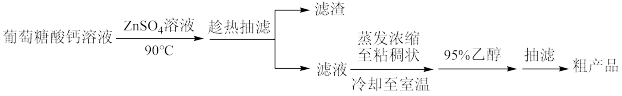
已知:①有关物质在水和乙醇中的溶解性:
②葡萄糖酸锌稍高于100℃即开始分解。
回答下列问题:
(1)反应须控温90℃,可以采用的加热方式为___ ,反应控温在90℃的原因为___ 。
(2)“趁热抽滤”的目的是___ 。在“蒸发浓缩至黏稠状,冷却至室温”后添加95%乙醇的作用是___ 。
(3)对粗产品进行提纯操作的名称是___ 。
(4)用EDTA(乙二胺四乙酸的二钠盐)滴定法测定粗产品中锌的含量,步骤如下:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTA10.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为___ 。
②该粗产品中Zn的质量分数为___ 。已知葡萄糖酸锌中Zn的质量分数为14.29%,则造成此次测定结果偏差的可能原因是___ 。
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管

已知:①有关物质在水和乙醇中的溶解性:
| 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 | |
| 水 | 可溶于冷水,易溶于热水 | 易溶 | 微溶 | |
| 乙醇 | 微溶 | 难溶 | ||
回答下列问题:
(1)反应须控温90℃,可以采用的加热方式为
(2)“趁热抽滤”的目的是
(3)对粗产品进行提纯操作的名称是
(4)用EDTA(乙二胺四乙酸的二钠盐)滴定法测定粗产品中锌的含量,步骤如下:
Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTA10.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为
②该粗产品中Zn的质量分数为
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管
2021·山东淄博·三模
类题推荐
锌是人体必须的一种微量元素,素有“生命之花”的美誉。工业上利用废锌铁合金(主要为Zn,含少量Fe、ZnO、Fe2O3等)和葡萄糖酸钙[ Ca(C6H11O7)2]为原料制备并测定葡萄糖酸锌纯度的流程如下:
I.葡萄糖酸锌[Zn(C6H11O7))2]的制备
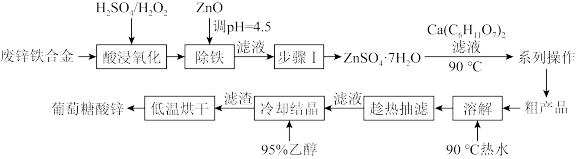
(1)加过量ZnO的目的是_______ (用离子方程式表示)。。
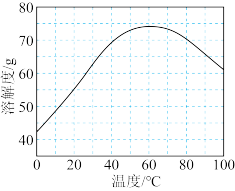
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”的操作是:在100℃蒸发溶剂;_______ ;_______ ;_______ ;冷却至室温;过滤。
(3)“趁热抽滤”的目的是_______ 。
(4)已知相关物质的溶解性如下表:
则实验中加入95%乙醇的目的是_______ 。
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn-EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:Zn-EBT(酒红色)+EDTA=Zn-EDTA+EBT(纯蓝色)。
其步骤如下:
步骤1.取5.200 g产品溶于水配成100 mL溶液,取25. 00 mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol•L-1EDTA10.00mL(过量);
步骤3.用1.000 mol•L-1锌标准溶液滴定至终点,平均消耗锌标准溶液18.00mL。
(5)步骤2中EDTA溶液已加过量时溶液的颜色为_______ 。
(6)样品中葡萄糖酸锌的质量分数为_______ 。
I.葡萄糖酸锌[Zn(C6H11O7))2]的制备

(1)加过量ZnO的目的是
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”的操作是:在100℃蒸发溶剂;

(3)“趁热抽滤”的目的是
(4)已知相关物质的溶解性如下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 |
| 水中的溶解性 | 易溶于热水 可溶于冷水 | 易溶于热水 可溶于冷水 | 易溶 | 微溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 难溶 | 难溶 |
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn-EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:Zn-EBT(酒红色)+EDTA=Zn-EDTA+EBT(纯蓝色)。
其步骤如下:
步骤1.取5.200 g产品溶于水配成100 mL溶液,取25. 00 mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol•L-1EDTA10.00mL(过量);
步骤3.用1.000 mol•L-1锌标准溶液滴定至终点,平均消耗锌标准溶液18.00mL。
(5)步骤2中EDTA溶液已加过量时溶液的颜色为
(6)样品中葡萄糖酸锌的质量分数为
葡萄糖酸锌[Zn(C6H11O7)2,相对分子质量 455]是一种有机补锌剂,广泛应用于食药领域。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:

已知:①有关物质在水和乙醇中的溶解性:
②葡萄糖酸锌稍高于 100℃即开始分解。
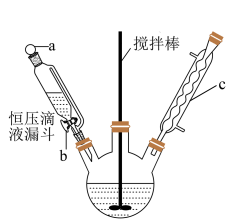
请回答:
(1)制备葡萄糖酸锌粗品(装置如图,夹持、控温装置略,恒压滴液漏斗中装的是Br2水):
①恒压滴液漏斗需要打开活塞______ (填“a”、“b”或“a 和 b”)。
②装置c的名称______________________ 。
(2)下列有关说法正确的是 。
(3)利用重结晶法可除去葡萄糖酸锌粗品中的硫酸钙杂质,提高产品的质量,选出葡萄糖酸锌重结晶过程中合理的操作并排序_______ (操作步骤可选择,但不可重复使用)。
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入 10mL95%乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在 50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入 10mL 蒸馏水,加热至微沸,加入葡萄糖酸锌粗品,得到葡萄糖酸锌饱和溶液
(4)测定产品纯度:取 mg 提纯后的产品溶于水配制成 100.00mL 溶液,取 25.00mL 置于锥形瓶中,向其中滴入少量 EBT 作为指示剂(遇 Zn2+生成 Zn—EBT),再加入过量的 V1mL c1mol/L EDTA 无色溶液(遇 Zn2+生成 Zn—EDTA),同时发生反应:
Zn—EBT(酒红色) + EDTA = Zn—EDTA(无色) + EBT(蓝色),再用 c2mol/L Zn2+标准溶液滴定至终点,三次滴定平均消耗锌标准溶液 V2mL。
①滴定终点现象为____________________________ 。
②该产品的纯度为_________________________________ (用含 m,c1、c2,V1、V2的代数式表示)。

已知:①有关物质在水和乙醇中的溶解性:
| 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 | |
| 水 | 可溶于冷水,易溶于热水 | 易溶 | 微溶 | |
| 乙醇 | 微溶 | 难溶 | ||

请回答:
(1)制备葡萄糖酸锌粗品(装置如图,夹持、控温装置略,恒压滴液漏斗中装的是Br2水):
①恒压滴液漏斗需要打开活塞
②装置c的名称
(2)下列有关说法正确的是 。
| A.步骤Ⅰ中的 Br2水可以用 KMnO4酸性溶液代替 |
| B.步骤Ⅱ反应完全的现象是不再产生气泡 |
| C.步骤Ⅲ中趁热过滤弃去的滤渣是 CaCO3 |
| D.步骤Ⅳ的一系列操作包括结晶、过滤、洗涤和干燥 |
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入 10mL95%乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在 50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入 10mL 蒸馏水,加热至微沸,加入葡萄糖酸锌粗品,得到葡萄糖酸锌饱和溶液
(4)测定产品纯度:取 mg 提纯后的产品溶于水配制成 100.00mL 溶液,取 25.00mL 置于锥形瓶中,向其中滴入少量 EBT 作为指示剂(遇 Zn2+生成 Zn—EBT),再加入过量的 V1mL c1mol/L EDTA 无色溶液(遇 Zn2+生成 Zn—EDTA),同时发生反应:
Zn—EBT(酒红色) + EDTA = Zn—EDTA(无色) + EBT(蓝色),再用 c2mol/L Zn2+标准溶液滴定至终点,三次滴定平均消耗锌标准溶液 V2mL。
①滴定终点现象为
②该产品的纯度为
锌是人体必须的一种微量元素,素有“生命之花”的美誉。工业上利用废锌铁合金(主要为Zn,含少量Fe、ZnO、Fe2O3等)和葡萄糖酸钙[Ca(C6H11O7)2]为原料制备并测定葡萄糖酸锌纯度的流程如图:
I.葡萄糖酸锌[Zn(C6H11O7)2]的制备
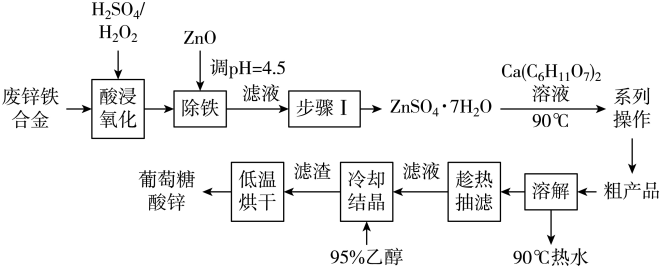
(1)加过量ZnO的目的是____ (用离子方程式表示)。
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”需要用到下列所有操作:

a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
上述操作的正确顺序是____ (操作可重复使用)。
(3)“趁热抽滤”的目的是___ 。
(4)已知相关物质的溶解性如表:
则实验中加入95%乙醇的目的是____ 。
(5)从粗产品到产品的过程简称为____ 。
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn—EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:
Zn—EBT(酒红色)+EDTA=Zn—EDTA+EBT(纯蓝色)
其步骤如下:
步骤1.取5.200g产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol·L-1EDTA10.00mL(过量);
步骤3.用1.000mol.L-1锌标准溶液进行滴定至终点,平均消耗锌标准溶液18.00mL。
(6)步骤2中EDTA溶液已加过量时溶液的颜色为____ 。
(7)样品中葡萄糖酸锌的质量分数为____ 。(葡萄糖酸锌的相对分子质量为455)
I.葡萄糖酸锌[Zn(C6H11O7)2]的制备

(1)加过量ZnO的目的是
(2)已知ZnSO4的溶解度随温度变化如图所示,“步骤I”需要用到下列所有操作:

a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
上述操作的正确顺序是
(3)“趁热抽滤”的目的是
(4)已知相关物质的溶解性如表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸锌 | 硫酸锌 | 硫酸钙 |
| 水中的溶解性 | 易溶于热水,可溶于冷水 | 易溶于热水,可溶于冷水 | 易溶 | 微溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 难溶 | 难溶 |
(5)从粗产品到产品的过程简称为
II.葡萄糖酸锌的纯度测定
制得产品之后,需要对产品的纯度进行测定以确定是否满足要求。以铬黑T(EBT)作为指示剂,用EDTA进行测定,原理为Zn2+与EBT作用可形成酒红色微粒Zn—EBT,由于EDTA与Zn2+结合能力更强,发生如下反应:
Zn—EBT(酒红色)+EDTA=Zn—EDTA+EBT(纯蓝色)
其步骤如下:
步骤1.取5.200g产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,再加入少量EBT作指示剂;
步骤2.在25.00mL溶液中加入2.000mol·L-1EDTA10.00mL(过量);
步骤3.用1.000mol.L-1锌标准溶液进行滴定至终点,平均消耗锌标准溶液18.00mL。
(6)步骤2中EDTA溶液已加过量时溶液的颜色为
(7)样品中葡萄糖酸锌的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


