解答题-原理综合题 适中0.65 引用2 组卷220
二氧化碳的综合利用是环保领域研究的热点课题。
Ⅰ. 经过催化氢化合成低碳烯烃。
经过催化氢化合成低碳烯烃。
合成乙烯的反应为
(1)已知几种化学键键能如下表所示:
则
___________ (用含字母的代数式表示)。
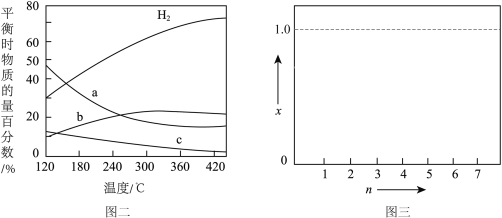
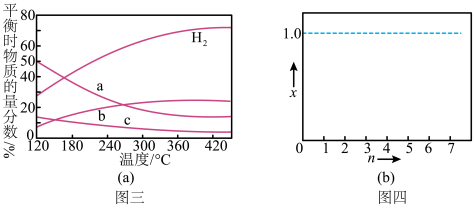
(2)反应温度、投料比 对
对 平衡转化率的影响如图1。
平衡转化率的影响如图1。
①
___________ 3(填“>”“<”或“=”,下同); 、
、 两点反应的平衡常数
两点反应的平衡常数
___________  。
。
② 时,往
时,往 刚性密闭容器中加入
刚性密闭容器中加入 、
、 ,反应
,反应 达到平衡,则反应开始和平衡时的总压强比为
达到平衡,则反应开始和平衡时的总压强比为___________ 。
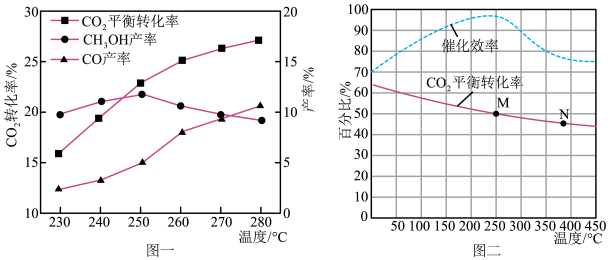
(3)某新型催化剂对 合成低碳烯烃在不同反应温度下的催化性能如图2。
合成低碳烯烃在不同反应温度下的催化性能如图2。
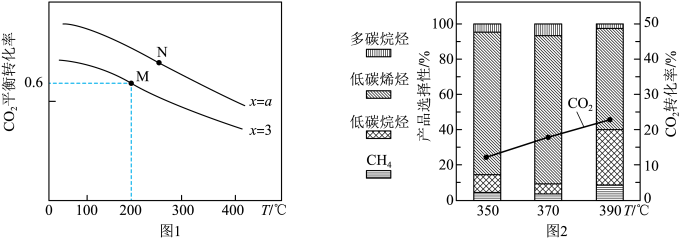
由图2可知,该反应最适宜的温度为___________ ,理由为___________ 。
Ⅱ. 经过电解转化为化工原料
经过电解转化为化工原料 。
。
(4)图3所示固体氧化物电解池利用具有优良催化活性的电极共电解 。
。
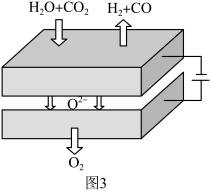
①阴极生成氢气的电极反应式为___________ 。
②电解过程中还伴随着积碳反应 。以下说法正确的是
。以下说法正确的是___________ (填标号)。
a.生成的碳覆盖在电极表面,影响电极的催化活性
b.生成的碳使电解效率降低
c.生成的碳会和电解产生的氧气反应
Ⅰ.
合成乙烯的反应为
(1)已知几种化学键键能如下表所示:
| 物质 | |||||
| 能量 |
则
(2)反应温度、投料比
①
②
(3)某新型催化剂对

由图2可知,该反应最适宜的温度为
Ⅱ.
(4)图3所示固体氧化物电解池利用具有优良催化活性的电极共电解

①阴极生成氢气的电极反应式为
②电解过程中还伴随着积碳反应
a.生成的碳覆盖在电极表面,影响电极的催化活性
b.生成的碳使电解效率降低
c.生成的碳会和电解产生的氧气反应
2021·福建南平·二模
知识点:根据△H=反应物的键能之和-生成物的键能之和进行计算化学平衡常数的影响因素及应用化学反应条件的控制及其应用电解池电极反应式及化学方程式的书写与判断 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网