解答题-结构与性质 适中0.65 引用2 组卷126
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子轨道排布式是_______ 。
(2)C、N、O三种元素第一电离能从小到大的顺序是_______ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是_______ 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有_______ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在_______ (填标号)。
a.离子键 b.共价键 c.范德华力 d.配位键
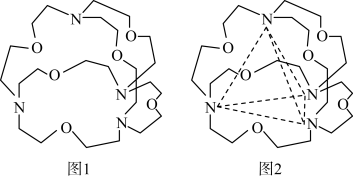
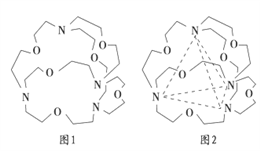
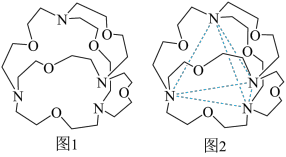
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_______ (填标号)。
a.CF4 b.NH c.H2O d.CH4
c.H2O d.CH4
(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是_______ 。
(1)基态氮原子的电子轨道排布式是
(2)C、N、O三种元素第一电离能从小到大的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

a.CF4 b.NH
(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是
20-21高二下·福建三明·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网