解答题-结构与性质 较难0.4 引用1 组卷325
卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
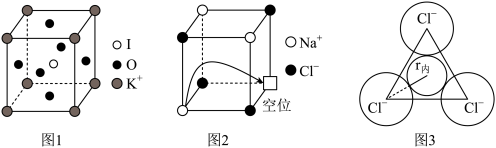
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
2021·吉林长春·模拟预测
类题推荐
卤族元素的单质及化合物性质丰富,在科研和生产中有许多重要用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,其中电负性最大的是___________ (填元素符号),溴原子的M能层电子排布式为___________ 。
(2)基态氯原子核外有___________ 种运动状态不同的电子,其中单电子占据的轨道形状为___________ 。
(3)下列物质性质递变规律正确的是___________。
(4)碘在水中的溶解度小,在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2
 。
。 离子的空间构型为
离子的空间构型为___________ 。
(5)SiCl4发生水解的机理如图:
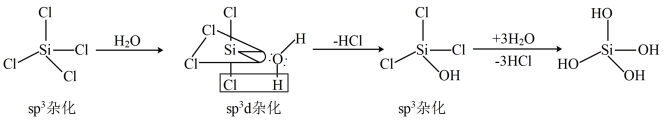
CCl4不能按照上述机理发生水解反应,原因是___________ 。
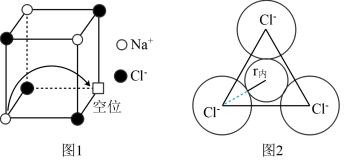
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确____________ 。(已知: ≈1.414,
≈1.414, ≈1.732)
≈1.732)
(1)卤族元素位于元素周期表的
(2)基态氯原子核外有
(3)下列物质性质递变规律正确的是___________。
| A.原子半径: F<C1<Br<I |
| B.第一电离能: F<Cl<Br<I |
| C.沸点:HCl<HBr<HI<HF |
| D.熔点: CaF2<CaCl2<CaBr2<CaI2 |
(5)SiCl4发生水解的机理如图:

CCl4不能按照上述机理发生水解反应,原因是
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确

I.钠元素和氯元素是两种重要的短周期元素,按要求完成问题。
(1)下列说法错误的是___________(填序号)
(2)常温下氯化钠晶体是绝缘体,温度升高导电性增强,导电的原因是钠离子迁移到空位造成(如下图所示)。已知:常温常压下NaCl晶胞参数a=564pm,r(Na+)=102pm,r(Cl-)=181pm。
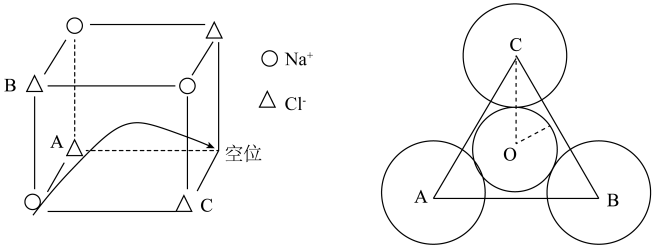
在氯化钠晶胞中钠离子的配位数为________ ,这些配位的氯离子形成的空间构型是_________ 。钠离子迁移时需穿过A、B、C3个氯离子形成的孔O,其平面位置关系如上图,孔O的半径___________ pm( =1.4,
=1.4, =1.7,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因
=1.7,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因___________ 。
II.
(3)一种晶体(属于立方晶系)中含有3种离子,其中A、B是阳离子,下图是这种晶体晶胞的中的八分之一,按要求回答问题。

若B是带有4个单位正电荷的阳离子,则A带的正电荷数是___________ ,若B在晶胞中的分数坐标是(0,0,0),则A的分数坐标是___________ ,A、B两种阳离子配位数之比为___________ ,晶胞参数为apm,O2-半径为bpm,两种阳离子均和O2-相切,B离子的半径为___________ pm。
(1)下列说法错误的是___________(填序号)
| A.第三周期元素中氯元素的第一电离能最大 |
| B.基态氯原子未成对电子数与基态钠原子相同 |
| C.短周期主族元素简单离子中钠离子的半径最大 |
| D.氯化钠的熔点高于溴化钠的熔点 |

在氯化钠晶胞中钠离子的配位数为
II.
(3)一种晶体(属于立方晶系)中含有3种离子,其中A、B是阳离子,下图是这种晶体晶胞的中的八分之一,按要求回答问题。

若B是带有4个单位正电荷的阳离子,则A带的正电荷数是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




