解答题-原理综合题 适中0.65 引用1 组卷198
氨气是一种重要的化工原料。
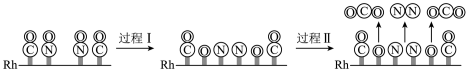
I.已知 298K、101kPa 下,合成氨反应的能量变化如图1所示(ad表示被催化剂吸附,反应历程中粒子均为气态)。
(1)该条件下,N2(g)+3H2(g) 2NH3 (g) ΔH =
2NH3 (g) ΔH =___________ 。
(2)反应历程中决定合成氨反应速率的一步反应的热化学方程式为___________ 。
(3)改变下列某一条件,既能加快合成氨反应速率又能提高氮气的平衡转化率的是___________ (填字母)。
A. 升高温度 B. 增大压强 C.增加 N2的量 D.及时分离氨气
Ⅱ.以氨气作还原剂,可除去烟气中的氮氧化物。其中除去 NO 的反应原理如下:4NH3 (g)+6NO(g) 5N2 (g)+6H2 O(g) ΔH= −1980 kJ/mol
5N2 (g)+6H2 O(g) ΔH= −1980 kJ/mol
(4)反应速率与浓度之间存在如下关系:v正=k正 c4 (NH3 )·c6 (NO),v逆 =k逆 c5 (N2 )·c6 (H2O) 。k正 、k逆 为速率常数,只受温度影响。350℃时,在 2L 恒容密闭容器中,通入 0.9mol NH3(g)和 1.2mol NO(g)发生反应,保持温度不变,平衡时 NO 的转化率为 50%,则此温度下
___________ ;当温度升高时,k正增大 m 倍,k逆增大 n 倍,则m ___________ n(填“>”、“<”或“=”)。
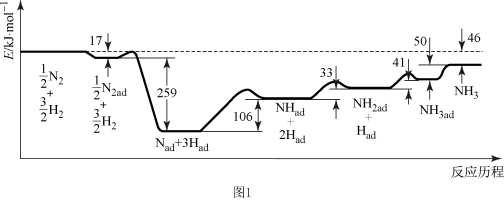
(5)初始投料量一定,平衡时 NO 的转化率与温度、压强的关系如图 2 所示,则 P1、P2、P3 由大到小的顺序为___________ ,原因是___________ 。
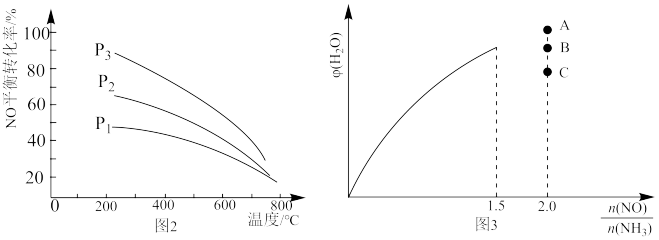
(6)保持温度不变,在恒容密闭容器中按一定比充入 NH3(g)和NO(g)发生反应,达到平衡时H2O(g)的体积分数 φ(H2O)随 的变化如图 3 所示,当
的变化如图 3 所示,当 时,达到平衡时 φ(H2O)可能是 A、B、C 三点中的
时,达到平衡时 φ(H2O)可能是 A、B、C 三点中的___________ (填“A”、“B”或“C”)。
I.已知 298K、101kPa 下,合成氨反应的能量变化如图1所示(ad表示被催化剂吸附,反应历程中粒子均为气态)。

(1)该条件下,N2(g)+3H2(g)
(2)反应历程中决定合成氨反应速率的一步反应的热化学方程式为
(3)改变下列某一条件,既能加快合成氨反应速率又能提高氮气的平衡转化率的是
A. 升高温度 B. 增大压强 C.增加 N2的量 D.及时分离氨气
Ⅱ.以氨气作还原剂,可除去烟气中的氮氧化物。其中除去 NO 的反应原理如下:4NH3 (g)+6NO(g)
(4)反应速率与浓度之间存在如下关系:v正=k正 c4 (NH3 )·c6 (NO),v逆 =k逆 c5 (N2 )·c6 (H2O) 。k正 、k逆 为速率常数,只受温度影响。350℃时,在 2L 恒容密闭容器中,通入 0.9mol NH3(g)和 1.2mol NO(g)发生反应,保持温度不变,平衡时 NO 的转化率为 50%,则此温度下
(5)初始投料量一定,平衡时 NO 的转化率与温度、压强的关系如图 2 所示,则 P1、P2、P3 由大到小的顺序为

(6)保持温度不变,在恒容密闭容器中按一定比充入 NH3(g)和NO(g)发生反应,达到平衡时H2O(g)的体积分数 φ(H2O)随
2021·吉林长春·模拟预测
类题推荐
氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为: △H<0
△H<0
(1)如图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________ (填写下列序号);t4时改变的条件是________________ 。
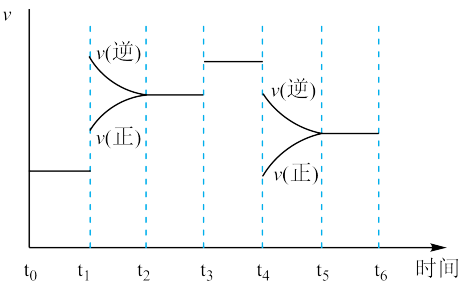
A t0→t1 B. t2→t3 C. t3→t4 D. t5→t6
(2)进行如下研究:在773K时,分别将2 mol N2和6 mol H2充入一个容积为V L的密闭容器中,随着反应的
进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
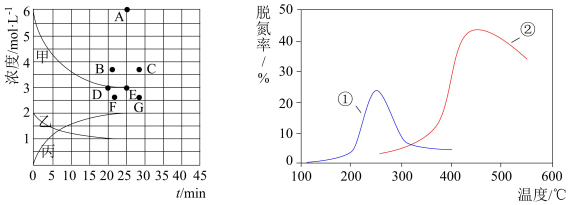
则该温度下,此反应的平衡常数的表达式为K=____________ 。
(3)由上表中的实验数据计算得到“浓度--时间”的关系可用左图中的曲线表示,表示c(H2)-t的曲线是____________ 。计算可知该容器的体积V为L;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________ 。
(4)改变下列某一条件,既能加快合成氨的速率又能提高N2的转化率的是_________。
(5)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mo/L、3 mol/L、3 mo/L,则此时V正_____ V逆(填">"“<”或“=”)。
(6)采用NH3作还原剂,除去烟气中的氮氧化物,反应原理为: 。图是烟气以固定的流速通过两种不同催化剂①和②时,测量相同时间得到的烟气脱氮率图象,由该图象可知下列说法中正确的是__________。
。图是烟气以固定的流速通过两种不同催化剂①和②时,测量相同时间得到的烟气脱氮率图象,由该图象可知下列说法中正确的是__________。
(7)以氨气作还原剂,可除去烟气中的氮氧化物。其中除去NO的反应原理如下:
 ,反应速率与浓度之间存在如下关系:
,反应速率与浓度之间存在如下关系: ,
, ,k正,k逆为速率常数,只受温度影响。350℃时,在2 L恒容密闭容器中,通入0.9 mol NH3(g)和1.2 mol NO(g)发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下
,k正,k逆为速率常数,只受温度影响。350℃时,在2 L恒容密闭容器中,通入0.9 mol NH3(g)和1.2 mol NO(g)发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下 =
=_______ ;温度升高时,k正增大m倍,k逆增大n倍,则m_______ n(填“>”、“<”或“=”)。
(1)如图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,t1、t3、t4时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是

A t0→t1 B. t2→t3 C. t3→t4 D. t5→t6
(2)进行如下研究:在773K时,分别将2 mol N2和6 mol H2充入一个容积为V L的密闭容器中,随着反应的
进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
则该温度下,此反应的平衡常数的表达式为K=
(3)由上表中的实验数据计算得到“浓度--时间”的关系可用左图中的曲线表示,表示c(H2)-t的曲线是

(4)改变下列某一条件,既能加快合成氨的速率又能提高N2的转化率的是_________。
| A.升温 | B.增大压强 | C.增大氮气的量 | D.及时分离氨气 |
(6)采用NH3作还原剂,除去烟气中的氮氧化物,反应原理为:
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450℃左右脱氮 |
| C.催化剂②比①脱氮效果好,说明催化剂②能导致该反应平衡向右移动程度更大 |
| D.相同条件下,改变压强对脱氮率没有影响 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网