解答题-原理综合题 适中0.65 引用1 组卷359
央广网消息:2020年大庆油田生产天然气46.6亿立方米,实现了“十连增”,在大战大考中交出了“当好标杆旗帜、建设百年油田”的新答卷。天然气的主要成分甲烷是一种重要的化工原料,广泛应用于民用和化工业生产中。回答下列问题:
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。∆H1=+196 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ∆H2=-484 kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ∆H3=-566 kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H=_______ 。
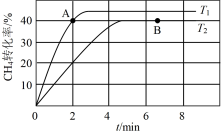
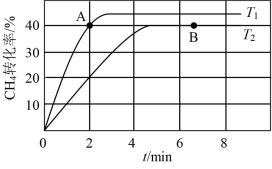
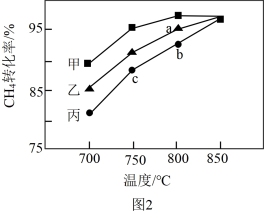
(2)在两个相同钢性密闭容器中充入CH4和CO2发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。
2CO(g)+2H2(g),CH4和CO2的分压均为20 kPa,加入催化剂Ni/α-Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图1所示。

图1
①A点处v正_______ B点处v逆(填“<”、“>”或“=”)。
②用单位时间内气体分压的变化来表示反应速率,即v= ,T2℃下,上述反应0~2min内平均反应速率v(CH4)=
,T2℃下,上述反应0~2min内平均反应速率v(CH4)=_______ kPa·min-1。(分压=总压×物质的量分数)
③上述反应达到平衡后,下列变化一定能使平衡向正向移动的是_____
A.通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
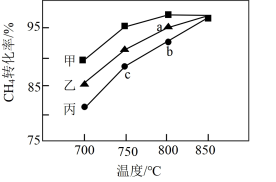
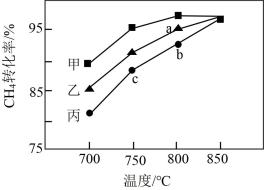
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图2所示。三种催化剂作用下,反应活化能最大的是_______ (填“甲”、“乙”或“丙”);CH4的转化率b点高于c点的原因是_______ 。
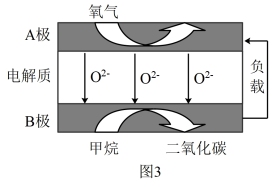
(4)我国科学家设计的新型甲烷燃料电池能量密度高、成本低,其工作原理如图3所示。B极电极反应式为_______ 。
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。∆H1=+196 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ∆H2=-484 kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ∆H3=-566 kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H=
(2)在两个相同钢性密闭容器中充入CH4和CO2发生反应:CH4(g)+CO2(g)

图1
①A点处v正
②用单位时间内气体分压的变化来表示反应速率,即v=
③上述反应达到平衡后,下列变化一定能使平衡向正向移动的是
A.通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图2所示。三种催化剂作用下,反应活化能最大的是

(4)我国科学家设计的新型甲烷燃料电池能量密度高、成本低,其工作原理如图3所示。B极电极反应式为

2021·黑龙江大庆·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网