解答题-原理综合题 适中0.65 引用3 组卷287
雾霾中含有多种污染物,其中包括氮氧化物 、
、 、
、 等。它们可以通过化学反应进行消除或转化。
等。它们可以通过化学反应进行消除或转化。
(1)氮硫的氧化物的转化:

已知:①

②

则
___________  。
。
一定条件下,将 与
与 以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有
以一定比例置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有___________ (填标号)。
a.混合气体的密度不变 b.混合气体颜色保持不变
c. 和
和 的体积比保持不变 d.反应速率
的体积比保持不变 d.反应速率
(2)碳氧化物的转化:
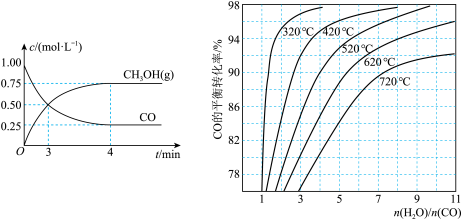
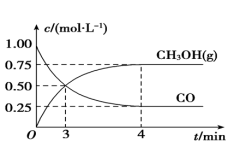
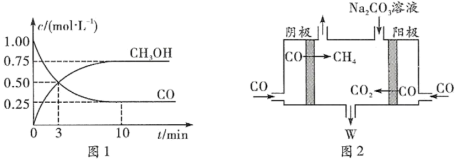
① 可用于合成甲醇,反应方程式为
可用于合成甲醇,反应方程式为 ,在一恒温恒容密闭容器中充入1
,在一恒温恒容密闭容器中充入1
 和2
和2
 进行上述反应。测得
进行上述反应。测得 和
和 浓度随时间的变化如图1所示。0~10
浓度随时间的变化如图1所示。0~10 内,氢气的平均反应速率为
内,氢气的平均反应速率为___________  ;第10
;第10 后,保持温度不变,向该密闭容器中再充入1
后,保持温度不变,向该密闭容器中再充入1
 和1
和1
 ,则平衡
,则平衡___________ 移动(填“正向”“逆向”或“不”)。
②电解 制备
制备 且电解质为碳酸钠溶液的工作原理如图2所示,写出阴极区电极反应式:
且电解质为碳酸钠溶液的工作原理如图2所示,写出阴极区电极反应式:___________ 。若以酸性条件下的甲醇燃料电池为电源进行电解,则标准状况下,生成1.12L 需要消耗的
需要消耗的 的质量为
的质量为___________ 。___________ (用离子方程式表示);室温时,向 溶液中滴入
溶液中滴入 溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:
溶液至溶液呈中性,则所得溶液中微粒浓度大小关系:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(1)氮硫的氧化物的转化:
已知:①
②
则
一定条件下,将
a.混合气体的密度不变 b.混合气体颜色保持不变
c.
(2)碳氧化物的转化:
①
②电解
2021高三·全国·专题练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网