解答题-实验探究题 较难0.4 引用2 组卷766
实验室制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的实验步骤如图:

i.向V2O5中加入足量盐酸酸化的N2H4·2HCl溶液,微沸数分钟。
ii.向制得的VOCl2溶液中缓慢加入足量NH4HCO3溶液,有气泡产生并析出紫红色晶体。
iii.反应结束后抽滤,用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,静置一段时间后得到产品。
请回答下列问题:
(1)步骤i中的还原剂是___ (填化学式)。
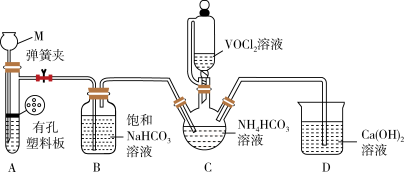
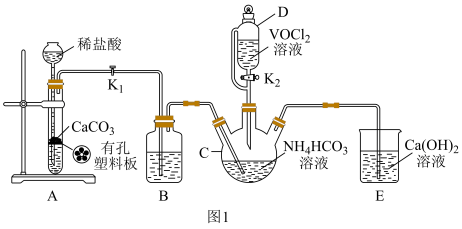
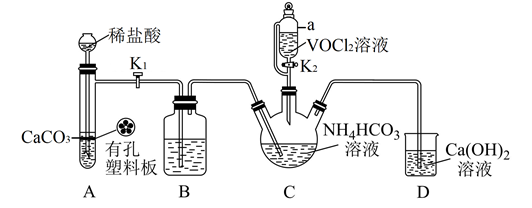
(2)已知VO2+能被O2氧化,步骤ii可在如图装置中进行(夹持仪器略去),利用A中反应产生的气体将C中空气排净。
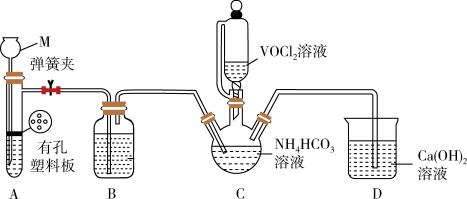
①仪器M的名称是___ 。
②装置B的作用是___ 。
(3)步骤ii中洗涤操作选择饱和NH4HCO3的原因是___ ,用无水乙醇洗涤的目的是___ 。
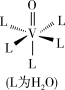
(4)蓝色VO2+的水合配离子的结构如图。向该水合配离子的溶液中加入NaOH至pH=12时,该水合配离子全部转化为褐色的[VO(OH)3]-,写出转化过程的离子方程式___ 。
(5)称量mg产品,用KMnO4溶液氧化,再除去多余的KMnO4(方法略),最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(滴定过程只发生反应VO +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL,产品中钒的质量分数为
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL,产品中钒的质量分数为___ %(用含有m、c、V的式子表示)。
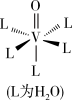

i.向V2O5中加入足量盐酸酸化的N2H4·2HCl溶液,微沸数分钟。
ii.向制得的VOCl2溶液中缓慢加入足量NH4HCO3溶液,有气泡产生并析出紫红色晶体。
iii.反应结束后抽滤,用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,静置一段时间后得到产品。
请回答下列问题:
(1)步骤i中的还原剂是
(2)已知VO2+能被O2氧化,步骤ii可在如图装置中进行(夹持仪器略去),利用A中反应产生的气体将C中空气排净。

①仪器M的名称是
②装置B的作用是
(3)步骤ii中洗涤操作选择饱和NH4HCO3的原因是
(4)蓝色VO2+的水合配离子的结构如图。向该水合配离子的溶液中加入NaOH至pH=12时,该水合配离子全部转化为褐色的[VO(OH)3]-,写出转化过程的离子方程式
(5)称量mg产品,用KMnO4溶液氧化,再除去多余的KMnO4(方法略),最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(滴定过程只发生反应VO
2021·山东德州·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网