解答题-工业流程题 适中0.65 引用3 组卷217
碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
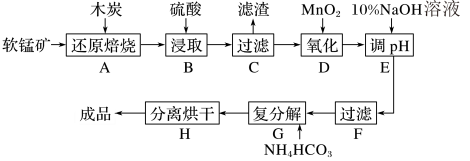
已知:还原焙烧的主反应为2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A操作时,需要用到的主要仪器名称为___________ 。
(2)步骤C中得到的滤渣成分有CaSO4、CaCO3、C和___________ ,步骤D中氧化剂与还原剂的物质的量之比为___________ 。
(3)步骤E中调节pH的范围为___________ ,其目的是___________ 。
(4)步骤G发生的离子方程式为___________ ,若Mn2+恰好沉淀完全时测得溶液中 的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___________ 。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为___________Mn2++___________S2O +___________H2O→___________H++___________SO
+___________H2O→___________H++___________SO +___________MnO
+___________MnO 。试配平该离子方程式。
。试配平该离子方程式。___________

已知:还原焙烧的主反应为2MnO2+C
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A操作时,需要用到的主要仪器名称为
(2)步骤C中得到的滤渣成分有CaSO4、CaCO3、C和
(3)步骤E中调节pH的范围为
(4)步骤G发生的离子方程式为
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为___________Mn2++___________S2O
2021·西藏拉萨·一模
类题推荐
(高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
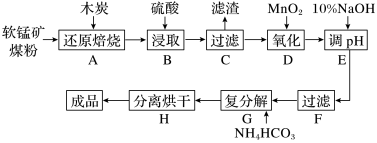
已知:还原焙烧主反应为2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________ 中加热。
(2)步骤E中调节pH的范围为_____ ,其目的是_______ 。
(3)若Mn2+恰好沉淀完全时测得溶液中CO 的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___ 。
(4)写出步骤G“沉锰”的离子方程式:________________________ 。

已知:还原焙烧主反应为2MnO2+C
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
(1)在实验室进行步骤A,混合物应放在
(2)步骤E中调节pH的范围为
(3)若Mn2+恰好沉淀完全时测得溶液中CO
(4)写出步骤G“沉锰”的离子方程式:
高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
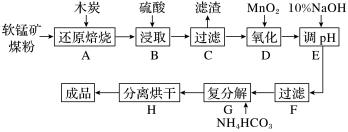
已知:还原焙烧主反应为2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________ 中加热。
(2)步骤E中调节pH的范围为____________ ,其目的是______________________________ 。
(3)步骤G,温度控制在35℃以下的原因是____________________________________ ,若Mn2+恰好沉淀完全(当离子浓度≦10-5mol/L认为该离子沉淀完全)时测得溶液中 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________ 。
(4)步骤D中氧化剂与还原剂的物质的量之比为__________ ;步骤C中的滤渣为__________ 。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________ 。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中 完全转化为
完全转化为 );加入稍过量的硫酸铵,发生反应NO2-+
);加入稍过量的硫酸铵,发生反应NO2-+ =N2↑+2H2O以除去
=N2↑+2H2O以除去 ;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2 ;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________ 。
②试样中锰元素的质量分数为____________ 。

已知:还原焙烧主反应为2MnO2+C
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
(1)在实验室进行步骤A,混合物应放在
(2)步骤E中调节pH的范围为
(3)步骤G,温度控制在35℃以下的原因是
(4)步骤D中氧化剂与还原剂的物质的量之比为
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为
②试样中锰元素的质量分数为
高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
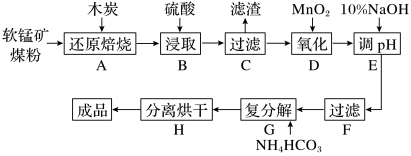
已知:还原焙烧主反应为2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________ 中加热;步骤C中的滤渣为__________ 。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________ 。
(3)步骤E中调节pH的范围为__________ ,其目的是__________ 。
(4)步骤G,温度控制在35℃以下的原因是__________ ,若Mn2+恰好沉淀完全时测得溶液中 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________ 。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________ 。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中 完全转化为
完全转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应 +
+ =N2↑+2H2O以除去
=N2↑+2H2O以除去 ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2 ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________ 。
②试样中锰元素的质量分数为__________ 。

已知:还原焙烧主反应为2MnO2+C
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
(1)在实验室进行步骤A,混合物应放在
(2)步骤D中氧化剂与还原剂的物质的量之比为
(3)步骤E中调节pH的范围为
(4)步骤G,温度控制在35℃以下的原因是
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为
②试样中锰元素的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


