解答题-原理综合题 适中0.65 引用1 组卷98
我国自主知识产权的首套煤基乙醇工业化项目生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。在1 L密闭容器中充入1 mol乙酸甲酯,乙酸甲酯转化为乙醇涉及反应原理:
主反应:CH3COOCH3(g)+2H2(g) C2H5OH(g)+CH3OH(g) ΔH1=-23.61 kJ·mol·L-1
C2H5OH(g)+CH3OH(g) ΔH1=-23.61 kJ·mol·L-1
副反应:CH3COOCH3(g)+C2H5OH(g) CH3COOC2H5 (g)+CH3OH(g) ΔH2=0.99 kJ·mol·L-1
CH3COOC2H5 (g)+CH3OH(g) ΔH2=0.99 kJ·mol·L-1
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OH CH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)反应2CH3COOCH3(g)+2H2(g) CH3COOC2H5(g)+2CH3OH(g)自发进行的条件是:
CH3COOC2H5(g)+2CH3OH(g)自发进行的条件是:____ 。
(2)能说明体系中主反应达到化学平衡状态的有____ 。
A.CH3COOCH3的质量分数不再变化 B.v正(C2H5OH)=v正(CH3OH)
C.容器中气体密度不再变化 D.体系的总压强不再变化
(3)乙酸甲酯的平衡转化率与温度和氢酯比(x)〖 〗的关系如图。
〗的关系如图。
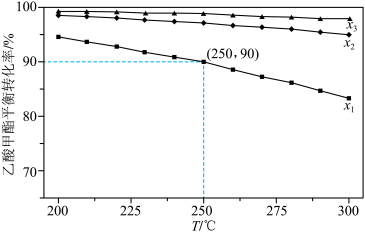
①比较x1、x2、x3的大小关系,最大的是___________ 。
②250℃、x1=5,C2H5OH的选择性为80%,则主反应的平衡常数为___________ (保留2位有效数字)。 。
。
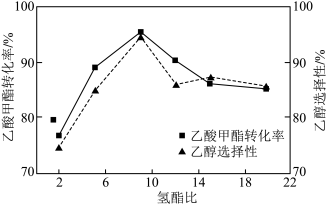
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为___________ 。
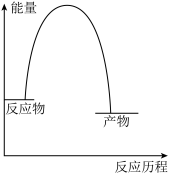
(5)若在未加催化剂的情况下主反应的能量反应历程示意图如图,请在图3中画出使用催化剂后该反应的能量反应历程示意图_______ 。
主反应:CH3COOCH3(g)+2H2(g)
副反应:CH3COOCH3(g)+C2H5OH(g)
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OH CH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)反应2CH3COOCH3(g)+2H2(g)
(2)能说明体系中主反应达到化学平衡状态的有
A.CH3COOCH3的质量分数不再变化 B.v正(C2H5OH)=v正(CH3OH)
C.容器中气体密度不再变化 D.体系的总压强不再变化
(3)乙酸甲酯的平衡转化率与温度和氢酯比(x)〖

①比较x1、x2、x3的大小关系,最大的是
②250℃、x1=5,C2H5OH的选择性为80%,则主反应的平衡常数为
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为

(5)若在未加催化剂的情况下主反应的能量反应历程示意图如图,请在图3中画出使用催化剂后该反应的能量反应历程示意图

20-21高二下·浙江杭州·期中
类题推荐
Ⅰ.习近平总书记在十九届中共中央政治局第三十六次集中学习时强调,实现碳达峰碳中和是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求。因此,二氧化碳的合理利用成为研究热点。
(1)以 和
和 为原料合成尿素是利用
为原料合成尿素是利用 的成功范例。在尿素合成塔中的主要反应可表示如下:
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:

反应Ⅱ:

总反应Ⅲ:

反应Ⅲ的
_______ kJ/mol,据此判断该反应在_______ (填“低温”、“高温”或“任意温度”)条件下能自发进行。
(2)用 还原
还原 可以合成
可以合成 。恒压下,
。恒压下, 和
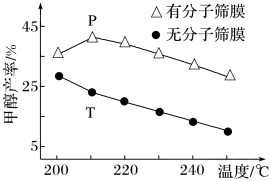
和 的起始物质的量之比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出
的起始物质的量之比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出 )时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为
)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为_______ 。
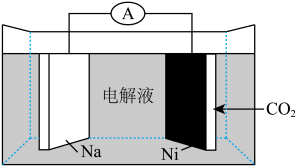
(3) 的再利用技术是促进可持续发展的措施之一,南开大学化学学院陈军院士课题组则成功研制出新型的
的再利用技术是促进可持续发展的措施之一,南开大学化学学院陈军院士课题组则成功研制出新型的 电池,如图是一种
电池,如图是一种 二次电池,其中钠和负载碳纳米管的银网分别作为电极材料,电池放电产物为
二次电池,其中钠和负载碳纳米管的银网分别作为电极材料,电池放电产物为 和C,则放电时正极电极反应式为
和C,则放电时正极电极反应式为_______ 。
Ⅱ.我国自主知识产权的首套煤机乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:

副反应:

在催化剂作用下的反应历程为(*表示吸附态):
化学吸附:
表面反应:
化学脱附:

已知:化学吸附的活化能大,决定主反应的反应速率。
(4)下列条件,有利于提高 平衡产率的是_______
平衡产率的是_______
(5)在1L恒容密闭容器中冲入 和1mol乙酸甲酯(g),乙酸甲酯(g)的平衡转化率与温度和氢酯比(x)[
和1mol乙酸甲酯(g),乙酸甲酯(g)的平衡转化率与温度和氢酯比(x)[ 氢气物质的量与乙酸甲酯物质的量之比]的关系如图
氢气物质的量与乙酸甲酯物质的量之比]的关系如图
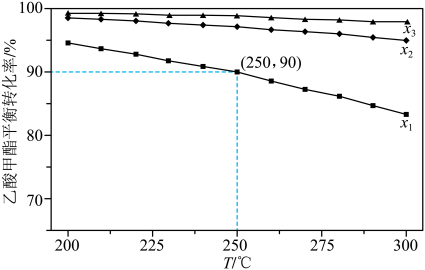
① 、
、 、
、 的大小关系为
的大小关系为_______ 。
②250℃、 ,
, 的选择性为60%,则主反应的平衡常数为
的选择性为60%,则主反应的平衡常数为_______ (保留2位有效数字)。(乙醇选择性 )
)
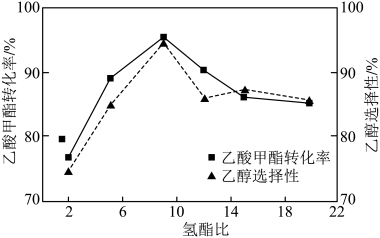
(6)其他条件相同,反应经过相同时间,乙酸甲酯(g)的转化率与乙醇的选择性随氢酯比的变化如图所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为_______ 。
(1)以
反应Ⅰ:
反应Ⅱ:
总反应Ⅲ:
反应Ⅲ的
(2)用

(3)

Ⅱ.我国自主知识产权的首套煤机乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:
副反应:
在催化剂作用下的反应历程为(*表示吸附态):
化学吸附:
表面反应:
化学脱附:
已知:化学吸附的活化能大,决定主反应的反应速率。
(4)下列条件,有利于提高
| A.低温 | B.高温 | C.低压 | D.高压 |

①
②250℃、
(6)其他条件相同,反应经过相同时间,乙酸甲酯(g)的转化率与乙醇的选择性随氢酯比的变化如图所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为

Ⅰ.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500 ℃时催化剂效果最好
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
(2)分析表格数据,为了使SO2尽可能多地转化为SO3,应选择______ ℃、______ Mpa下进行实验。
(3)在实际生产中,选定的温度为400~500 ℃,原因是___
(4)在实际生产中,采用的压强为常压,原因是______
(5)在实际生产中,通入过量的空气,原因是_____
(6)尾气中SO2必须回收,原因是______
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:

已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为_____ ,CH3CH2OH(g)的体积分数为_____ %(保留一位小数)。
(8)此温度下,该反应的化学平衡常数Kp=_____ MPa-1(用平衡分压代替平衡浓度计算,列出计算式,不要求计算结果)。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
| A.SO2的体积分数不再变化 | B.混合物的密度不再变化 |
| C.v(SO2)=2v(O2) | D.气体的压强不再变化 |
(3)在实际生产中,选定的温度为400~500 ℃,原因是
(4)在实际生产中,采用的压强为常压,原因是
(5)在实际生产中,通入过量的空气,原因是
(6)尾气中SO2必须回收,原因是
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)

已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为
(8)此温度下,该反应的化学平衡常数Kp=
甲醇是重要的化工原料,又是可再生能源,工业合成甲醇有如下几种方法:
(1)水煤气合成法。制备甲醇的主要反应为CO(g)+2H2(g)⇌CH3OH(g)。原料气的加工过程中常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇的产率是不同的。实验数据如下表所示。
由表中数据分析可知:一定条件下,CO2对甲醇合成的影响是_______ 。
(2)CO2催化转化法:以CO2、H2为原料在催化剂作用下合成CH3OH涉及的主要反应:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1
II.CO(g)+2H2(g) ⇌CH3OH(g) △H2=-90.4kJ·mol-1
III.CO2(g)+H2(g) ⇌CO(g)+H2O(g) △H3
①△H3=_______ 。
②一定条件下,向2L恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,经5min达到平衡时,容器中CH3OH(g)为a mol,CO(g)为b mol,则这段时间内以H2O(g)表示的化学反应速率为_______ mol·L-1·min-1。(用含a、b的代数式表示)。
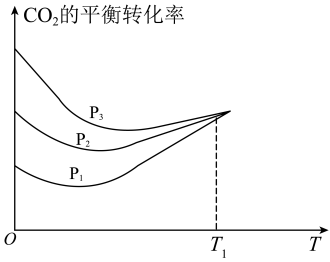
③不同压强下,按照n(CO2):n(H2)=1:3投料,实验测得CO2的平衡转化率随温度(T)变化关系如图所示。则压强P1、P2、P3由大到小的顺序为_______ ,温度高于T1时,CO2的平衡转化率几乎相等的原因是_______ 。
(3)甲烷催化氧化法:
主反应:2CH4(g)+O2(g) ⇌2CH3OH(g)
副反应:CH4(g)+2O2(g) ⇌CO2(g)+2H2O(g)
①科学家将CH4、O2和H2O(g) (H2O是活性催化剂)按照一定体积比在催化剂表面合成甲醇部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
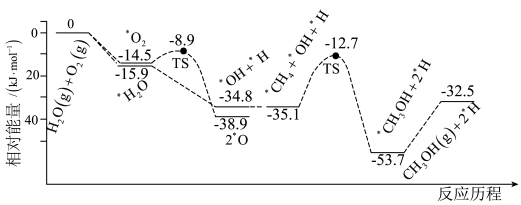
该历程中正反应的最大活化能为_______ kJ·mol-1,写出该步骤的化学方程式_______ 。
②向恒温刚性容器中按照体积比为2:1:7充入CH4、O2和H2O(g),在500K下反应达到平衡时,CH3OH的选择性(甲醇的选择性= ×100%)为90%,CH4的转化率为50%,则副反应的压强平衡常数KP=
×100%)为90%,CH4的转化率为50%,则副反应的压强平衡常数KP=_______ (保留小数点后一位)。
(1)水煤气合成法。制备甲醇的主要反应为CO(g)+2H2(g)⇌CH3OH(g)。原料气的加工过程中常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇的产率是不同的。实验数据如下表所示。
| φ(CO2)-φ(CO)-φ(H2)/% | 0-30-70 | 4-26-70 | 8-22-70 | 20-10-70 | ||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 碳转化率/% | 4.9 | 8.8 | 11.0 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
(2)CO2催化转化法:以CO2、H2为原料在催化剂作用下合成CH3OH涉及的主要反应:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1
II.CO(g)+2H2(g) ⇌CH3OH(g) △H2=-90.4kJ·mol-1
III.CO2(g)+H2(g) ⇌CO(g)+H2O(g) △H3
①△H3=
②一定条件下,向2L恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,经5min达到平衡时,容器中CH3OH(g)为a mol,CO(g)为b mol,则这段时间内以H2O(g)表示的化学反应速率为
③不同压强下,按照n(CO2):n(H2)=1:3投料,实验测得CO2的平衡转化率随温度(T)变化关系如图所示。则压强P1、P2、P3由大到小的顺序为

(3)甲烷催化氧化法:
主反应:2CH4(g)+O2(g) ⇌2CH3OH(g)
副反应:CH4(g)+2O2(g) ⇌CO2(g)+2H2O(g)
①科学家将CH4、O2和H2O(g) (H2O是活性催化剂)按照一定体积比在催化剂表面合成甲醇部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。

该历程中正反应的最大活化能为
②向恒温刚性容器中按照体积比为2:1:7充入CH4、O2和H2O(g),在500K下反应达到平衡时,CH3OH的选择性(甲醇的选择性=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


