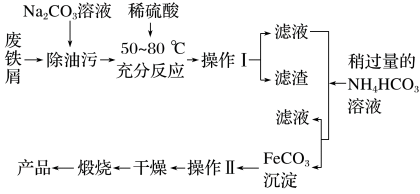
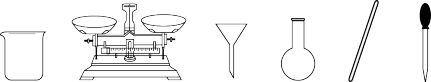解答题-工业流程题 适中0.65 引用1 组卷171
以MnSO4为原料生产MnO2的工艺流程如图:
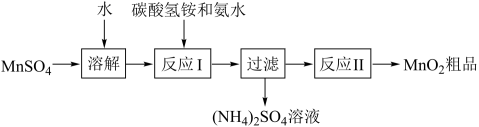
(1)工业上常用二氧化锰为原料,采用铝热反应冶炼金属锰。写出该反应的化学方程式:_______ 。
(2)MnSO4中基态锰离子的核外电子排布式_______ 。
(3)过滤所得滤渣为MnCO3,写出反应Ⅰ的离子方程式:_______ 。
(4)为测定粗品中MnO2的质量分数,进行如下实验:
步骤Ⅰ:准确称取1.4500 g MnO2粗品于锥形瓶中,向其中加入稀H2SO4和25.00 mL 1.000 mol·L-1 FeSO4溶液(过量)充分反应。
步骤Ⅱ:向反应后溶液中滴加0.04000mol·L-1 KMnO4溶液与剩余的FeSO4反应,反应结束时消耗KMnO4溶液 25.00 mL。
已知杂质不参与反应,实验过程中的反应如下:
MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;MnO +8H++5Fe2+=Mn2++5Fe3++4H2O
+8H++5Fe2+=Mn2++5Fe3++4H2O
①实验室由FeSO4·7H2O晶体配制100 mL 1.000 mol·L-1 FeSO4溶液所需的玻璃仪器有玻璃棒、胶头滴管、烧杯、_______ 。
②下列情况会使得所配FeSO4溶液浓度偏高的是_______ (填字母)。
a.称量前FeSO4·7H2O晶体已部分失水
b.FeSO4溶液转移后烧杯未洗涤
c.定容时加水超过刻度线
③通过计算确定粗品中MnO2的质量分数为_______ (写出计算过程)。

(1)工业上常用二氧化锰为原料,采用铝热反应冶炼金属锰。写出该反应的化学方程式:
(2)MnSO4中基态锰离子的核外电子排布式
(3)过滤所得滤渣为MnCO3,写出反应Ⅰ的离子方程式:
(4)为测定粗品中MnO2的质量分数,进行如下实验:
步骤Ⅰ:准确称取1.4500 g MnO2粗品于锥形瓶中,向其中加入稀H2SO4和25.00 mL 1.000 mol·L-1 FeSO4溶液(过量)充分反应。
步骤Ⅱ:向反应后溶液中滴加0.04000mol·L-1 KMnO4溶液与剩余的FeSO4反应,反应结束时消耗KMnO4溶液 25.00 mL。
已知杂质不参与反应,实验过程中的反应如下:
MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;MnO
①实验室由FeSO4·7H2O晶体配制100 mL 1.000 mol·L-1 FeSO4溶液所需的玻璃仪器有玻璃棒、胶头滴管、烧杯、
②下列情况会使得所配FeSO4溶液浓度偏高的是
a.称量前FeSO4·7H2O晶体已部分失水
b.FeSO4溶液转移后烧杯未洗涤
c.定容时加水超过刻度线
③通过计算确定粗品中MnO2的质量分数为
19-20高一下·江苏南通·阶段练习
类题推荐
二氧化锰(MnO2)、高锰酸钾(KMnO4)均是常用的氧化剂。回答下列问题:
(1)MnO2能将SO2氧化生成MnSO4,反应的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s) △H。
已知:
I.MnO2(s)=Mn(s)+O2(g) △H1=+520 kJ·mol-1
II.S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol-1
III.Mn(s)+2O2(g)+S(s)=MnSO4(s) △H3=-1065 kJ·mol-1
则上述反应的△H=_________ kJ·mol-1。
(2)某同学在实验室用标准Na2S2O3溶液测定KMnO4粗品的纯度,步骤如下:
①用_________ (填仪器名称)称取0.7 g KMnO4粗品于锥形瓶中,加入一定量的蒸馏水将其溶解,然后加入_________ (填“稀盐酸”或“稀硫酸”)进行酸化。
②250 mL 0.10 mol·L-1标准Na2S2O3溶液的配制,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和_________ 。
③将①所得溶液用0.10 mol·L-1的标准Na2S2O3溶液进行滴定。滴定至终点时记录消耗的Na2S2O3溶液体积如下表:
该KMnO4产品的纯度为_________ (保留3位有效数字)。已知有关离子方程式为8 +5
+5 +14H+=10
+14H+=10 +8Mn2++7H2O。
+8Mn2++7H2O。
(1)MnO2能将SO2氧化生成MnSO4,反应的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s) △H。
已知:
I.MnO2(s)=Mn(s)+O2(g) △H1=+520 kJ·mol-1
II.S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol-1
III.Mn(s)+2O2(g)+S(s)=MnSO4(s) △H3=-1065 kJ·mol-1
则上述反应的△H=
(2)某同学在实验室用标准Na2S2O3溶液测定KMnO4粗品的纯度,步骤如下:
①用
②250 mL 0.10 mol·L-1标准Na2S2O3溶液的配制,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和
③将①所得溶液用0.10 mol·L-1的标准Na2S2O3溶液进行滴定。滴定至终点时记录消耗的Na2S2O3溶液体积如下表:
实验次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液体积/mL | 19.97 | 20.02 | 20.01 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网