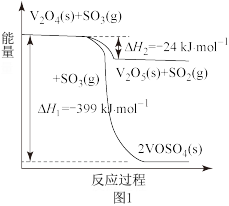解答题-原理综合题 适中0.65 引用4 组卷361
硫酸是一种重要的化工原料。工业上生产硫酸的步骤之一是SO2与O2反应生成SO3。
(1)已知一定条件下该反应消耗3.2g氧气时,放出的热量为19.8kJ,则该反应的热化学方程式为___________ 。727℃时,该反应的平衡常数Kp=3.45×10-5Pa-1( ,式中p为反应达平衡时各气体的分压),恒温恒容体系中,SO2、O2和SO3的分压分别为2.02×104Pa、1.01×104Pa和1.01×105
,式中p为反应达平衡时各气体的分压),恒温恒容体系中,SO2、O2和SO3的分压分别为2.02×104Pa、1.01×104Pa和1.01×105
Pa时,反应___________ 向进行(填“正”或“逆”);若开始时体系中只有SO2和O2,两种气体的分压分别为2.02×104Pa和1.01×104Pa,达平衡时,SO2的分压为aPa,则Kp=___________ Pa-1(列表达式)。
(2)铅酸蓄电池已有160多年历史,至今仍在多领域发挥着重要作用。在铅酸蓄电池生产过程中,一般是先将铅粉(主要成分为铅和氧化铅)与硫酸溶液混合,调制成铅膏后均匀地涂敷在铅板栅上,经干燥得到生极板。生极板化成(通入直流电使铅酸蓄电池的两极发生电化学反应的过程)、封装后,即可得到市售铅酸蓄电池。
①化成时,作为铅酸蓄电池负极的生极板应连接外电源的___________ 极。
②过充电时,铅酸蓄电池正极对应的电极反应式为___________ 。长时间使用后,电池内硫酸的浓度将___________ (填“变大”、“变小”或“不变”)。
③单位质量的电池理论上输出的能量称为理论质量比能量。已知,铅酸蓄电池的电压为2V,产生1Ah的电量消耗3.86g铅。铅酸蓄电池的理论质量比能量为___________ W·h·kg-1(填标号)。
A.518 B.449 C.197 D.167
(1)已知一定条件下该反应消耗3.2g氧气时,放出的热量为19.8kJ,则该反应的热化学方程式为
Pa时,反应
(2)铅酸蓄电池已有160多年历史,至今仍在多领域发挥着重要作用。在铅酸蓄电池生产过程中,一般是先将铅粉(主要成分为铅和氧化铅)与硫酸溶液混合,调制成铅膏后均匀地涂敷在铅板栅上,经干燥得到生极板。生极板化成(通入直流电使铅酸蓄电池的两极发生电化学反应的过程)、封装后,即可得到市售铅酸蓄电池。
①化成时,作为铅酸蓄电池负极的生极板应连接外电源的
②过充电时,铅酸蓄电池正极对应的电极反应式为
③单位质量的电池理论上输出的能量称为理论质量比能量。已知,铅酸蓄电池的电压为2V,产生1Ah的电量消耗3.86g铅。铅酸蓄电池的理论质量比能量为
A.518 B.449 C.197 D.167
2021·河北·模拟预测
类题推荐
二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
(1)I:2SO2(g)+O2(g) 2SO3(g) ΔH1=-197.7kJ/mol K1(浓度平衡常数)
2SO3(g) ΔH1=-197.7kJ/mol K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O5催化剂的密闭容器装置:

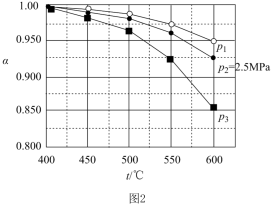
在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2进行投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________ (用“甲、乙、丙”表示)。
(2)在容器丙中,0.1 MPa条件下,在不同温度或不同投料方式下研究上述反应,得到数据如下表:
①表中:a=___________ 。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=___________ MPa-1。
③451℃时,若按0.4 mol SO2、0.4mol O2、0.4 mol SO3进行投料,则反应开始时v正(SO2)___________ v逆(SO2)(填“>”、“<”或“=”)。
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g) SO3(g)+NO(g) △H2 K2(浓度平衡常数)
SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g) 2NO2(g) △H3=-114.1 kJ/mol K3(浓度平衡常数),△H2=
2NO2(g) △H3=-114.1 kJ/mol K3(浓度平衡常数),△H2=___________ ;K3=___________ (用含有K1、K2的表达式表示)。
(1)I:2SO2(g)+O2(g)
为研究该反应,某同学设计了以下三种已装固体V2O5催化剂的密闭容器装置:

在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2进行投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为
(2)在容器丙中,0.1 MPa条件下,在不同温度或不同投料方式下研究上述反应,得到数据如下表:
| 实验序号 | A组 | B组 | C组 |
| 反应温度 | 451℃ | 451℃ | 551℃ |
| 投料方式(按照SO2、O2、SO3的顺序) | 2 mol 、1mol、0 mol | 0mol 、0mol 、2mol | 2mol 、1mol 、0mol |
| 含硫化合物的转化 | 60% | b | c |
| 反应的热量变化 | 放热a | 吸热79.08kJ | 放热 |
| 压强平衡常数(Kp) | Kp1 | Kp1 | Kp2 |
①表中:a=
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=
③451℃时,若按0.4 mol SO2、0.4mol O2、0.4 mol SO3进行投料,则反应开始时v正(SO2)
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g)
Ⅲ:2NO(g)+O2(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网