解答题-实验探究题 适中0.65 引用1 组卷293
氮及其化合物在生产生活中有着广泛的应用,但同时随意排放氮的化合物也会造成环境污染问题。
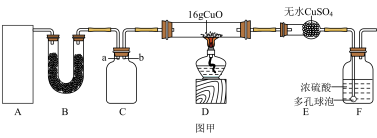
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:
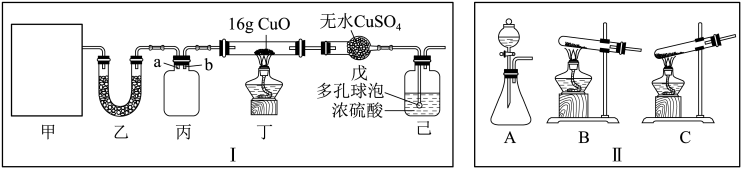
(1)实验室制备氨气有多种方法,现欲用NH4Cl与熟石灰反应制取NH3,则甲中的气体发生装置为___ (从II中选用)。
(2)装置丙用于收集NH3,应将导管___ (填“a”或“b”)延长至集气瓶底部,装置乙中盛放的试剂为___ ,装置己的作用为___ 、___ (答两点)。
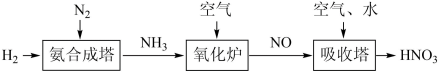
II.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
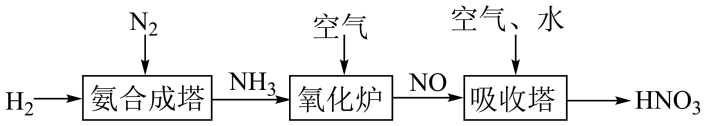
(1))氨气在“氧化炉”中所发生反应的化学方程式为_____ 。
(2)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:__+NO2→ +__+CO2,请完成离子方程式:
+__+CO2,请完成离子方程式:__ 。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__ 。
III.国家规定地下水中氮氧化物的排放标准不超过400mg∙L-1.氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为NO+Fe2+=Fe(NO)2+;NO2+3Fe2++2H+=2Fe3++Fe(NO)2++H2O。现测定某地下水脱硝过程中氮氧化物的排放量:收集500.00mL排放的气体,缓慢通过250.00mL0.6240mol∙L-1酸性FeSO4溶液(过量),充分反应,量取吸收气体后的溶液25.00mL置于锥形瓶中,用0.2000mol∙L-1酸性KMnO4溶液反应过量的Fe2+(还原产物为Mn2+),重复上述实验操作3次,平均消耗酸性KMnO4溶液的体积为15.00mL。试通过计算分析地下水脱硝过程中氮氧化物的排放是否符合国家标准(写出计算过程)___ 。(已知Fe(NO)2+与酸性KMnO4溶液不反应)
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略)制取干燥的氨气并验证NH3具有还原性,请回答下列问题:

(1)实验室制备氨气有多种方法,现欲用NH4Cl与熟石灰反应制取NH3,则甲中的气体发生装置为
(2)装置丙用于收集NH3,应将导管
II.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1))氨气在“氧化炉”中所发生反应的化学方程式为
(2)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:__+NO2→
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
III.国家规定地下水中氮氧化物的排放标准不超过400mg∙L-1.氮氧化物可以用酸性硫酸亚铁溶液来吸收,反应原理为NO+Fe2+=Fe(NO)2+;NO2+3Fe2++2H+=2Fe3++Fe(NO)2++H2O。现测定某地下水脱硝过程中氮氧化物的排放量:收集500.00mL排放的气体,缓慢通过250.00mL0.6240mol∙L-1酸性FeSO4溶液(过量),充分反应,量取吸收气体后的溶液25.00mL置于锥形瓶中,用0.2000mol∙L-1酸性KMnO4溶液反应过量的Fe2+(还原产物为Mn2+),重复上述实验操作3次,平均消耗酸性KMnO4溶液的体积为15.00mL。试通过计算分析地下水脱硝过程中氮氧化物的排放是否符合国家标准(写出计算过程)
20-21高一下·江苏无锡·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网