解答题-原理综合题 较难0.4 引用1 组卷244
研究大气中含硫化合物(主要是 和
和 )的转化率具有重要意义。
)的转化率具有重要意义。
(1)土壤中的微生物可将大气中的 经两步反应氧化成
经两步反应氧化成 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
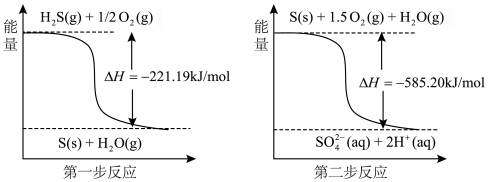
 全部氧化成
全部氧化成 的热化学方程式为
的热化学方程式为___________ 。
(2) 是工业制硫酸的原料气体之一,一定温度下,向容积为
是工业制硫酸的原料气体之一,一定温度下,向容积为 的密闭容器中充入一定量的
的密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: ,过程中测定的部分数据见表:
,过程中测定的部分数据见表:
①反应在 内的平均速率为
内的平均速率为
___________ ;
②此温度下该反应的化学平衡常数K=___________ ;
③研究表明, 催化氧化的反应速率方程为:
催化氧化的反应速率方程为: 。式中:k为反应速率常数,随温度t升高而增大;
。式中:k为反应速率常数,随温度t升高而增大; 为
为 平衡转化率,
平衡转化率, 为某时刻
为某时刻 转化率,n为常数。在
转化率,n为常数。在 时,将一系列温度下的k、
时,将一系列温度下的k、 值代入上述速率方程,得到v~t曲线如图所示。
值代入上述速率方程,得到v~t曲线如图所示。
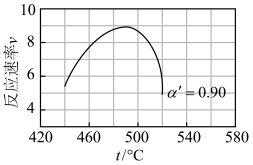
曲线上v最大值所对应温度称为该 下反应的最适宜温度
下反应的最适宜温度 。下列说法正确的是
。下列说法正确的是___________ 。
A.v达到最大值时, 平衡转化率
平衡转化率 最大
最大
B.温度是影响反应速率的主要因素,温度越高,反应速率越快
C. 后,v逐渐下降,原因是升高温度,
后,v逐渐下降,原因是升高温度, 逐渐降低
逐渐降低
D.t<tm时,v逐渐提高,原因是升高温度,k逐渐增大
(3)一般来说,如果一个反应的平衡常数大于 ,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于
,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于 ,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
,则认为这个反应很难进行。已知常温下各物质的溶度积及电离平衡常数:
 ,
,
计算反应 反应的平衡常数
反应的平衡常数
___________ 。
(4)工业上常用 与碳酸钠溶液的反应制备焦亚硫酸钠(
与碳酸钠溶液的反应制备焦亚硫酸钠( ),
), 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留量时,取
残留量时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。滴定反应的离子方程式为
。滴定反应的离子方程式为___________ ,该样品中 的残留量为
的残留量为___________  (以
(以 计,保留三位有效数字)。
计,保留三位有效数字)。
(1)土壤中的微生物可将大气中的

(2)
| 时间/ | ||
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
①反应在
②此温度下该反应的化学平衡常数K=
③研究表明,

曲线上v最大值所对应温度称为该
A.v达到最大值时,
B.温度是影响反应速率的主要因素,温度越高,反应速率越快
C.
D.t<tm时,v逐渐提高,原因是升高温度,k逐渐增大
(3)一般来说,如果一个反应的平衡常数大于
计算反应
(4)工业上常用
20-21高二下·四川成都·阶段练习
类题推荐
研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是________ ,潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式________________________________ .
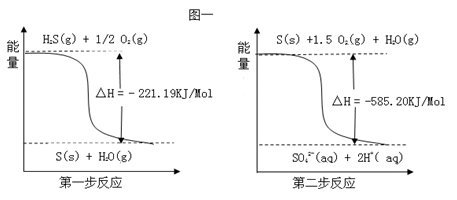
(2) 土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化示意图1如下:1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为__________________ 。
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g),过程中测定的部分数据见表:
①反应在0~4min内的平均速率为v(SO2)=___________ ;
②此温度下该反应的化学平衡常数K=_________ ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将__________ (填“减小”,“增大”或“不变”).
(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
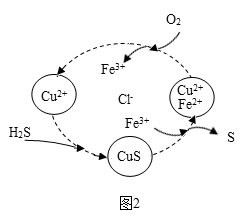
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有_________ .
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:CuS:Ksp=6.3×10﹣36; H2S:K a1=1.0×10﹣7,K a2=7.0×10﹣15,计算反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)反应的平衡常数K=____________ ,则该反应_______ 进行(填“难”、“易”)。
(1)SO2的大量排放会引起严重的环境问题是
(2) 土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化示意图1如下:1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为

(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g),过程中测定的部分数据见表:
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=
②此温度下该反应的化学平衡常数K=
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将
(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:

①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:CuS:Ksp=6.3×10﹣36; H2S:K a1=1.0×10﹣7,K a2=7.0×10﹣15,计算反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)反应的平衡常数K=
研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是_____________ ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式___________________
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为___________________
(3)SO2时工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
①反应在0-4min内的平均速率为v(SO2)=_________ ;
②此温度下该反应的化学平衡常数K=__________ 。
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),重新达到平衡时混合气体中SO2的百分含量将___________ (填“减小”、“增大”或“不变”。)
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化入右图所示:

①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有__________________ 。
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较安全;相反,如果一个反应的平衡常数夏普与10-5,则认为这个反应很难进行。
已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:Ka1=1.3×10-7,Ka2=7.1×10-15,
通过计算说明反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)进行的程度_________
(1)SO2的大量排放会引起严重的环境问题是
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为
(3)SO2时工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
①反应在0-4min内的平均速率为v(SO2)=
②此温度下该反应的化学平衡常数K=
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),重新达到平衡时混合气体中SO2的百分含量将
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化入右图所示:

①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较安全;相反,如果一个反应的平衡常数夏普与10-5,则认为这个反应很难进行。
已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:Ka1=1.3×10-7,Ka2=7.1×10-15,
通过计算说明反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)进行的程度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网