解答题-原理综合题 较难0.4 引用2 组卷267
利用 可消除CO污染或定量测定CO,反应为:
可消除CO污染或定量测定CO,反应为:
完成下列填空:
(1)该反应的平衡常数表达式
___________ 。在2L恒容密闭容器中反应25min后,固体质量减少了6.4g,则0~25min  的平均反应速率为
的平均反应速率为___________ 。
(2)取一定量的 和CO于某密闭容器中,分别在80
和CO于某密闭容器中,分别在80 和100
和100 下进行实验,测得
下进行实验,测得 如下:
如下:
上表中
___________ ,理由是___________ 。根据上表数据可以得出的结论是___________ 。
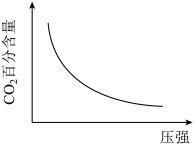
(3)如图所示,300 时
时 的百分含量随着压强的增大而减小,请解释其原因
的百分含量随着压强的增大而减小,请解释其原因___________ 。
(4) 可用高浓度NaOH溶液吸收。
可用高浓度NaOH溶液吸收。
①若4.48L (标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为
(标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为___________ 。
②继续通入二氧化碳至溶液中碳酸钠和碳酸氢钠(碳酸氢钠溶液呈碱性)的物质的量之比1∶1,则溶液中各离子浓度大小顺序为___________ 。
③若使碳酸氢钠溶液中 的比值变小,可加入的物质是
的比值变小,可加入的物质是___________ 。
a.通入HCl b.NaOH固体 c.通入 d.
d. 固体
固体
完成下列填空:
(1)该反应的平衡常数表达式
(2)取一定量的
| 时间/min 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| 80 | 0.50 | 0.37 | 0.26 | 0.18 | 0.12 | 0.12 |
| 100 | 0.50 | 0.35 | 0.24 | 0.17 | x | 0.15 |
上表中
(3)如图所示,300

(4)
①若4.48L
②继续通入二氧化碳至溶液中碳酸钠和碳酸氢钠(碳酸氢钠溶液呈碱性)的物质的量之比1∶1,则溶液中各离子浓度大小顺序为
③若使碳酸氢钠溶液中
a.通入HCl b.NaOH固体 c.通入
2021·上海浦东新·二模
类题推荐
为实现“碳中和”,可以使二氧化碳与氢气反应,一定条件下,CO2和H2可发生如下两个平行反应:
i.CO2(g)+H2(g) CO(g)+H2O(g)-42kJ
CO(g)+H2O(g)-42kJ
ii.CO2(g)+3H2(g) CH3OH(g)+H2O(g)+49.6kJ
CH3OH(g)+H2O(g)+49.6kJ
(1)为了提高CH3OH的产率,理论上应采用的措施是(填编号)______ 。
(2)保持温度533K,压强3MPa,按投料比 =
= 向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如表所示(已知CH3OH选择性:转化的CO2中生成CH3OH的百分比)。
向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如表所示(已知CH3OH选择性:转化的CO2中生成CH3OH的百分比)。
上述条件下,使用cat.2作催化剂,下列说法能判断反应ii达到平衡状态的是______ (填编号)
(3)一定条件下,向0.5L恒容密闭容器中充入1molCO2和3molH2,只发生上述反应ii,达平衡时,H2的转化率为80%,则该温度下的平衡常数K=______ (保留两位小数)。
(4)若恒容密闭容器中只发生上述反应i,在进气比n(CO2):n(H2)不同、温度不同时,测得相应的CO2平衡转化率如图所示,则B和D两点的温度T(B)______ T(D)(填“<”,“>”,或“=”),结合平衡常数分析原因:______ 。

在工业生产和环境保护中,可以用NaOH溶液捕获CO2,减少碳排放,可得到Na2CO3和NaHCO3两种盐。
(5)0.1mol/L的NaHCO3溶液中c(OH-)>c(H+),用水解和电离理论的角度解释其原因______ ;若往溶液中加入氨水至中性,则c(Na+)______ c( )+c(
)+c( )+c(H2CO3)(填“>”、“﹤”或“=”)。
)+c(H2CO3)(填“>”、“﹤”或“=”)。
(6)往0.1mol/L的Na2CO3溶液加入少量Na2CO3固体,完全溶解后溶液中c(Na+):c(CO )的比值
)的比值______ (填“变大”、“变小”或“保持不变”)。
i.CO2(g)+H2(g)
ii.CO2(g)+3H2(g)
(1)为了提高CH3OH的产率,理论上应采用的措施是(填编号)
| A.低温低压 | B.高温低压 | C.高温高压 | D.低温高压 |
| 催化剂 | CO2转化率 | CH3OH选择性 |
| cat.1 | 21.9% | 67.3% |
| cat.2 | 36.1% | 100.0% |
| A.气体压强不再变化 |
| B.气体平均相对分子质量不再变化 |
| C.CH3OH和H2O的物质的量之比为1:1 |
| D.CO2和H2的物质的量之比不再变化 |
(4)若恒容密闭容器中只发生上述反应i,在进气比n(CO2):n(H2)不同、温度不同时,测得相应的CO2平衡转化率如图所示,则B和D两点的温度T(B)

在工业生产和环境保护中,可以用NaOH溶液捕获CO2,减少碳排放,可得到Na2CO3和NaHCO3两种盐。
(5)0.1mol/L的NaHCO3溶液中c(OH-)>c(H+),用水解和电离理论的角度解释其原因
(6)往0.1mol/L的Na2CO3溶液加入少量Na2CO3固体,完全溶解后溶液中c(Na+):c(CO
在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=_______ mol/(L·min);实验2中采取的措施是_______ ;实验3中n3_______ 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_______ 0(填“>、=、<”),理由是_______
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的_______ 。
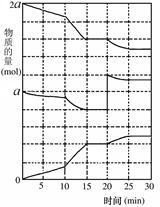
a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是_______ ,_______ 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是_______ 。
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
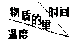 实验序号 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 80℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 80℃ | n2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 80℃ | n3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 73℃ | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc=
②比较实验4和实验1,可推测该反应中Q
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的

a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
按要求完成下列题目
(1)下列反应中,属于吸热反应的是______(填字母)。
(2)利用中和实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL 0.50 的盐酸,则还需加入______(填序号)。
的盐酸,则还需加入______(填序号)。
(3)在体积为1L密闭容器中充入3mol 和9mol
和9mol  ,发生反应
,发生反应
 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
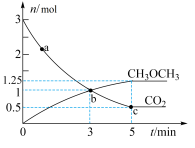
①反应到达3min时,
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②0~5min内,
______  。
。
③反应达到平衡状态时, 的体积分数为
的体积分数为______ %(保留1位小数)。
(4)在常温下对反应 进行研究。若将3mol NO和2mol CO通入10L的恒容密闭容器中,在一定条件下发生上述反应,各组分的物质的量浓度随时间的变化情况如图所示。
进行研究。若将3mol NO和2mol CO通入10L的恒容密闭容器中,在一定条件下发生上述反应,各组分的物质的量浓度随时间的变化情况如图所示。
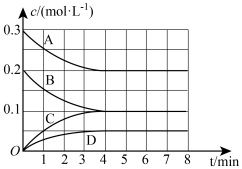
①图中曲线A表示______ (填“NO”“CO”“ ”或“
”或“ ”,下同)的浓度变化,曲线C表示的是
”,下同)的浓度变化,曲线C表示的是______ 浓度变化。
②在0~4min内NO的平均反应速率
______ ,4min末 的浓度为
的浓度为______ 。
③4min末,采用下列措施一定能加快上述反应速率的是______ (填标号)。
A.升高体系的温度 B.充入一定量的 C.将容器体积变为5L D.充入一定量氦气
C.将容器体积变为5L D.充入一定量氦气
④下列叙述能说明反应达到平衡状态的是______ (填字母)。
A.容器内压强保持不变 B. 与
与 的物质的量之比为1∶1
的物质的量之比为1∶1
C.气体的密度保持不变 D.混合气体的平均相对分子质量不变
(1)下列反应中,属于吸热反应的是______(填字母)。
| A.C与水蒸气反应 | B.氧化钙和水反应 |
| C. | D.锌与盐酸反应 |
(2)利用中和实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL 0.50
| A.1.0g NaOH固体 | B.50mL 0.55 | C.50mL 0.50 |
(3)在体积为1L密闭容器中充入3mol

①反应到达3min时,
②0~5min内,
③反应达到平衡状态时,
(4)在常温下对反应

①图中曲线A表示
②在0~4min内NO的平均反应速率
③4min末,采用下列措施一定能加快上述反应速率的是
A.升高体系的温度 B.充入一定量的
④下列叙述能说明反应达到平衡状态的是
A.容器内压强保持不变 B.
C.气体的密度保持不变 D.混合气体的平均相对分子质量不变
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


