解答题-工业流程题 较难0.4 引用4 组卷352
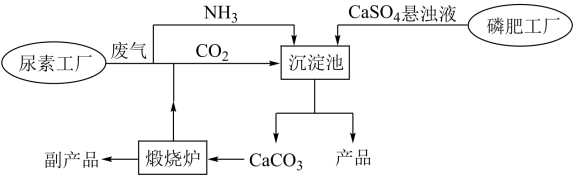
“绿色化学”是化工生产中的重要理念。下图为利用尿素工厂废气以及磷肥工厂废渣(液)联合生产硫酸铵的工艺流程。
完成下列填空:
(1)沉淀池中发生反应的化学方程式为___________ 。已知硫酸铵溶解度变化趋势与氯化钠相似,则从沉淀池中获得产品的操作包含___________ 、___________ 、洗涤、烘干等。
(2)流程中体现“绿色化学”理念的设计有___________ 、___________ 等。
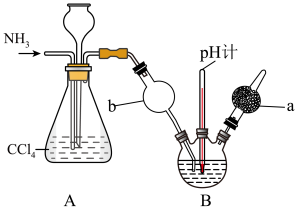
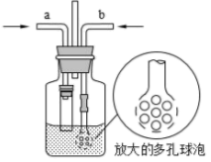
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是___________ ;导管b下端使用多孔球泡的目的是___________ 。
可用甲醛法测定所得 样品中氮的质量分数。其反应原理可以表示为:
样品中氮的质量分数。其反应原理可以表示为:
 [已知:
[已知: 不与NaOH反应]
不与NaOH反应]
实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是___________ 。
(5)已知 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为
,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为___________ 。(保留4位小数),实验测得硫酸铵样品中氮的质量分数略高,原因可能是___________ 。
a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗

完成下列填空:
(1)沉淀池中发生反应的化学方程式为
(2)流程中体现“绿色化学”理念的设计有
(3)为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是

可用甲醛法测定所得
实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)终点的判断依据是
(5)已知
a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗
2021·上海浦东新·二模
类题推荐
高氯酸铵 为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
 高氯酸铵中氯元素的化合价为
高氯酸铵中氯元素的化合价为_____________ 。
 高氯酸铵在高温条件下分解会产生H
高氯酸铵在高温条件下分解会产生H 和三种单质气体,请写出该分解反应的化学方程式
和三种单质气体,请写出该分解反应的化学方程式____________________________ 。
 某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。
某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。 已知:焦性没食子酸溶液用于吸收氧气
已知:焦性没食子酸溶液用于吸收氧气
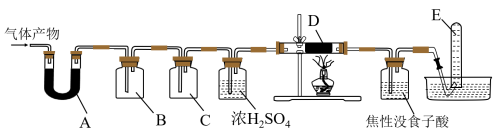
 装置A、B、C、D中盛放的药品可以依次为
装置A、B、C、D中盛放的药品可以依次为__________  选填序号:Ⅰ、Ⅱ或Ⅲ
选填序号:Ⅰ、Ⅱ或Ⅲ 。
。
Ⅰ 碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
Ⅱ 无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
Ⅲ 无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
 装置E收集到的气体可能是
装置E收集到的气体可能是_____________  填化学式
填化学式 。
。
 经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)
经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)在实验室制取
NH4ClO4(aq)+NaCl(aq)在实验室制取 ,该反应中各物质的溶解度随温度的变化曲线如图。
,该反应中各物质的溶解度随温度的变化曲线如图。
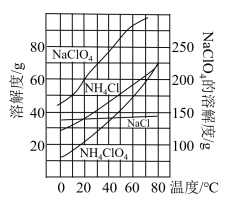
 从混合溶液中获得较多粗NH
从混合溶液中获得较多粗NH ClO
ClO 晶体的实验操作依次为
晶体的实验操作依次为________ 、_________ 和过滤、洗涤、干燥。
 研究小组分析认为,若用氨气和浓盐酸代替NH
研究小组分析认为,若用氨气和浓盐酸代替NH Cl,则上述反应不需要外界供热就能进行,其原因是
Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________ 。
 研究小组通过甲醛法测定所得产品NH
研究小组通过甲醛法测定所得产品NH ClO
ClO 的质量分数。
的质量分数。 已知:NH
已知:NH ClO
ClO 的相对分子质量为
的相对分子质量为 ;NH
;NH ClO
ClO 与甲醛反应的离子方程式为
与甲醛反应的离子方程式为 ,
, N
N H
H

 N
N

实验步骤:
步骤Ⅰ 称取
称取 样品。
样品。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取
移取 样品溶液于250mL锥形瓶中,加入
样品溶液于250mL锥形瓶中,加入 的中性甲醛溶液
的中性甲醛溶液 过量
过量 ,摇匀、静置5min后,加入
,摇匀、静置5min后,加入 滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复
滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复 滴定
滴定 操作2次。
操作2次。
 标准液应盛放在上图装置
标准液应盛放在上图装置_________  填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ” 中,判断达到滴定终点的现象是
中,判断达到滴定终点的现象是__________ 。
 滴定结果如下表所示:
滴定结果如下表所示:
则所用标准溶液的体积为___________ mL,若NaOH标准溶液的浓度为 ,则该产品中
,则该产品中 的质量分数为
的质量分数为_____________ 。

Ⅰ
Ⅱ
Ⅲ


实验步骤:
步骤Ⅰ
步骤Ⅱ
步骤Ⅲ

| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度 | 滴定后刻度 | |
| 1 | ||
| 2 | ||
| 3 | ||
重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。某化学兴趣小组对重铬酸铵的一些性质及组成进行探究。已知: (橙色)
(橙色) (黄色)
(黄色) 。回答下列问题:
。回答下列问题:
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是_______ ,写出该反应的化学方程式:_______ 。
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。
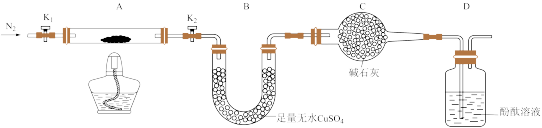
①实验过程中通入N2的主要目的是_______ 。
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为_______ 。
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4↓+2H+,4
+H2O=2BaCrO4↓+2H+,4 +6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
+6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使 完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_______ (填“偏大”“偏小”或“无影响”);滴定时边滴边摇动锥形㼛,眼睛应观察_______ 。
②滳定结果如下表所示:
该样品中氮的质量分数为_______ (结果保留两位小数)。
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++
实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使
①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数
②滳定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.06 |
| 2 | 25.00 | 1.98 | 21.97 |
| 3 | 25.00 | 0.20 | 21.20 |
| 4 | 25.00 | 0.45 | 20.45 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网