解答题-工业流程题 适中0.65 引用3 组卷325
硒是人体所需微量元素之一,也是一种重要的工业原料。
Ⅰ.硒在元素周期表中的位置如图所示:
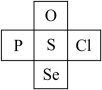
(1)从原子结构的角度解释硫的非金属性比硒强的原因是__ 。
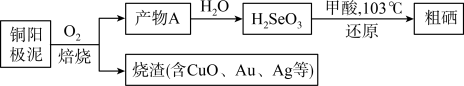
Ⅱ.工业上从铜阳极泥(含有Se、Au、Ag、Cu、CuSe、Ag2Se等)中提取硒的过程如图:
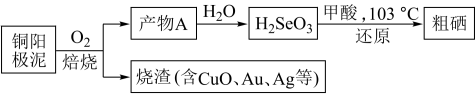
(2)焙烧时,产物A的化学式为__ 。
(3)将甲酸(HCOOH)还原H2SeO3反应的化学方程式补充完整:H2SeO3+2HCOOH Se+
Se+ +
+ 。
。______ 。
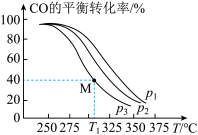
(4)常温下,H2SeO3电离平衡体系中含Se(+4价)微粒的物质的量分数与pH的关系如图所示。
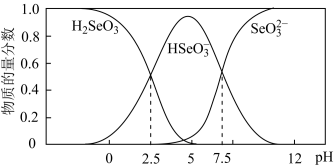
向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式__ 。
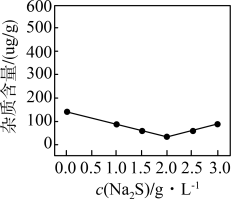
(5)还原时,进行了下述实验:向10mL2.5mol·L-1亚硒酸溶液中先加入10mL氨水,再加入10mL甲酸溶液(甲酸浓度分别为5、7.5及10mol·L-1),加热至沸腾(103℃),反应10小时,实验数据如图所示。
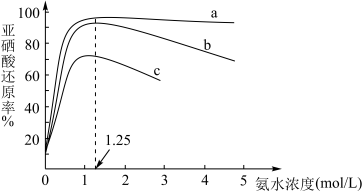
①曲线___ (填曲线字母编号)对应甲酸浓度为10mol·L-1,判断的理由是___ 。
②当氨水浓度在0~1.25mol·L-1之间,随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,其可能的原因是__ 。
(6)粗硒中硒含量测定:
在一定条件下,将0.1000g粗硒中的Se完全转化为H2SeO3溶液,用V1mL0.1000mol·L-1Na2S2O3溶液进行滴定。终点前加入KI淀粉溶液做指示剂,继续用V2mL0.1000mol·L-1Na2S2O3溶液滴定至溶液蓝色消失。发生的反应:
H2SeO3+4S2O +4H+=Se+2S4O
+4H+=Se+2S4O +3H2O
+3H2O ;
;
H2SeO3+4I-+4H+=Se+2I2+3H2O;
I2+2S2O =2I-+S4O
=2I-+S4O 。则粗硒中Se的质量分数为
。则粗硒中Se的质量分数为___ 。
Ⅰ.硒在元素周期表中的位置如图所示:

(1)从原子结构的角度解释硫的非金属性比硒强的原因是
Ⅱ.工业上从铜阳极泥(含有Se、Au、Ag、Cu、CuSe、Ag2Se等)中提取硒的过程如图:

(2)焙烧时,产物A的化学式为
(3)将甲酸(HCOOH)还原H2SeO3反应的化学方程式补充完整:H2SeO3+2HCOOH
 +
+ 。
。(4)常温下,H2SeO3电离平衡体系中含Se(+4价)微粒的物质的量分数与pH的关系如图所示。

向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式
(5)还原时,进行了下述实验:向10mL2.5mol·L-1亚硒酸溶液中先加入10mL氨水,再加入10mL甲酸溶液(甲酸浓度分别为5、7.5及10mol·L-1),加热至沸腾(103℃),反应10小时,实验数据如图所示。

①曲线
②当氨水浓度在0~1.25mol·L-1之间,随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,其可能的原因是
(6)粗硒中硒含量测定:
在一定条件下,将0.1000g粗硒中的Se完全转化为H2SeO3溶液,用V1mL0.1000mol·L-1Na2S2O3溶液进行滴定。终点前加入KI淀粉溶液做指示剂,继续用V2mL0.1000mol·L-1Na2S2O3溶液滴定至溶液蓝色消失。发生的反应:
H2SeO3+4S2O
H2SeO3+4I-+4H+=Se+2I2+3H2O;
I2+2S2O
2021·北京顺义·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网