解答题-实验探究题 0.4 引用1 组卷179
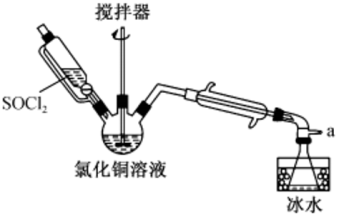
氯化亚铜(CuCl)是一种见光易分解的白色固体,难溶于水,在潮湿的环境中易被氧气氧化为碱式氯化铜。实验室用SOCl2与CuCl2溶液混合制取CuCl的装置如图所示。
已知:
①SOCl2是一种易发烟的液体,遇水剧烈水解生成SO2和HCl气体;
②CuCl在溶液中存在如下平衡:CuCl(s)+3Cl-(aq) [CuCl4]3-(aq)(无色)。
[CuCl4]3-(aq)(无色)。
回答下列问题:
(1)配制CuCl2溶液所需的蒸馏水需要去氧气,最简单的去氧操作是_______ 。
(2)当三颈烧瓶的溶液由_____ 时(填实验现象),则说明反应已经完成,可以停止实验。
(3)实验结束后需要先向三颈烧瓶中加入去氧水,然后再进行过滤得到CuCl。加水的作用是____ ,过滤时需要在避光的条件下进行,原因是_____ 。
(4)经过滤得到的CuCl沉淀,先用无水乙醇洗涤,然后在真空干燥机内于70℃下干燥2小时,冷却,密封保存。“70℃真空干燥”的目的是_____ 。
(5)久置在空气中的CuCl可完全变质为碱式氯化铜[xCuCl2·yCu(OH)2,其x、y为整数],为探究该碱式氯化铜的组成,设计如下实验步骤:
①准确称取4.216g样品,溶于足量乙酸中,加蒸馏水配制成100mL溶液;
②取25mL溶液,向其中加入足量的AgNO3溶液,充分反应后过滤、洗涤、干燥,所得白色固体质量为0.574g;
③另取25mL溶液,向其中加入过量的KI溶液,再用0.400mol·L-1的Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知滴定过程涉及如下反应:2Cu2++4I-=2CuI↓+I2、2 +I2=2I-+
+I2=2I-+ 。
。
计算碱式氯化铜中x=_____ ;y=____ 。

已知:
①SOCl2是一种易发烟的液体,遇水剧烈水解生成SO2和HCl气体;
②CuCl在溶液中存在如下平衡:CuCl(s)+3Cl-(aq)
回答下列问题:
(1)配制CuCl2溶液所需的蒸馏水需要去氧气,最简单的去氧操作是
(2)当三颈烧瓶的溶液由
(3)实验结束后需要先向三颈烧瓶中加入去氧水,然后再进行过滤得到CuCl。加水的作用是
(4)经过滤得到的CuCl沉淀,先用无水乙醇洗涤,然后在真空干燥机内于70℃下干燥2小时,冷却,密封保存。“70℃真空干燥”的目的是
(5)久置在空气中的CuCl可完全变质为碱式氯化铜[xCuCl2·yCu(OH)2,其x、y为整数],为探究该碱式氯化铜的组成,设计如下实验步骤:
①准确称取4.216g样品,溶于足量乙酸中,加蒸馏水配制成100mL溶液;
②取25mL溶液,向其中加入足量的AgNO3溶液,充分反应后过滤、洗涤、干燥,所得白色固体质量为0.574g;
③另取25mL溶液,向其中加入过量的KI溶液,再用0.400mol·L-1的Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知滴定过程涉及如下反应:2Cu2++4I-=2CuI↓+I2、2
计算碱式氯化铜中x=
20-21高三·河南·阶段练习


