解答题-结构与性质 较难0.4 引用1 组卷373
微量元素硼(B)对人体健康有着十分重要的作用,其化合物也应用广泛。请回答下列问题:
(1)B的核外电子排布式为___ ,其第一电离能比Be___ (填“大”或“小”)。
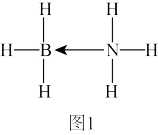
(2)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由___ 提供(填元素符号)。写出一种与氨硼烷互为等电子体的分子___ (填分子式)。
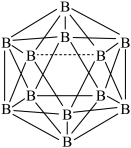
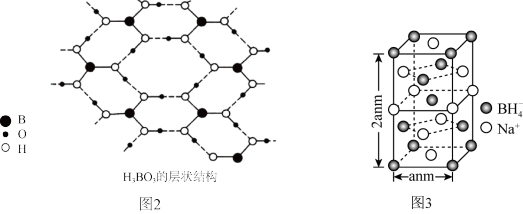
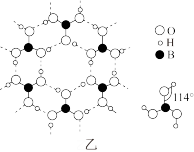
(3)硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有___ 。
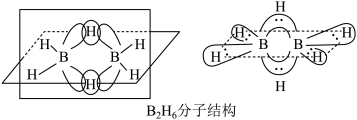
(4)①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH 构成,BH
构成,BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为___ ,BH 的空间构型为
的空间构型为___ 。
②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是___ 。
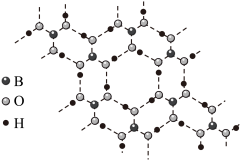
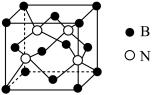
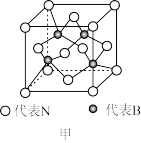
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图乙所示。立方氮化硼属于___ 晶体,其中氮原子的配位数为___ 。已知:立方氮化硼密度为ρg·cm-3,B原子半径为anm,N原子半径为bnm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为___ (用含字母的代数式表示)。
(1)B的核外电子排布式为
(2)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由
(3)硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有


(4)①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH
②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是
| 化合物 | BF3 | BCl3 | BBr3 | BI3 |
| 熔点/℃ | -126.8 | -107.3 | -46 | 44.9 |
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图乙所示。立方氮化硼属于
2021·黑龙江大庆·一模
类题推荐
开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为_____________ ;LiBH4中Li和B原子半径为Li______________ B(填“>”“<”或“=”)。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为_______________________ 。

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键____ (填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为_____ 。
②B、C、N与O元素的第一电离能由大到小的顺序为______________ 。
(3)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
①该金属元素是_______________ (填元素符号).
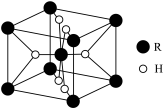
②若氢化物的晶胞结构如图所示(有4个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为_____________ cm3[用含ρ、NA的代数式表示(其中NA为阿伏加德罗常数的值)]。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键
②B、C、N与O元素的第一电离能由大到小的顺序为
(3)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
| I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
②若氢化物的晶胞结构如图所示(有4个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网