解答题-原理综合题 较难0.4 引用5 组卷648
二甲醚是一种重要的化工原料,回答下列问题:
(1)已知:①C(s)+ O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
O2(g)=CO(g) ∆H1=-111. 8 kJ/mol;
②C(s)+ H2O(g)=CO(g) +H2(g) ∆H2 =130 kJ/mol;
③CO(g)+ 2H2(g)=CH3OH(g) ∆H3=- 90.1 kJ/mol;
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4= -134 kJ/mol。
则CH3OCH3(g)+ O2 (g)=2CO(g)+3H2(g) ∆H=
O2 (g)=2CO(g)+3H2(g) ∆H=______ kJ/mol;该反应能够自发进行所采用的有利条件是______ (填“高温”“低温”或“任意温度”)。
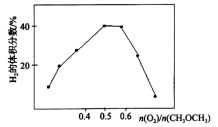
(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是______ ;研究发现,所得平衡混合气体中H2的体积分数随n(O2)/n(CH3OCH3)变化如图所示,试解释该曲线先变大后减小的原因______ 。
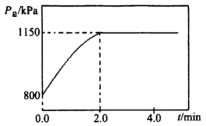
(3)某温度下,在VL的刚性容器中充入4.0molCH3OCH3、2.0molO2及2.0molH2O(g),在催化剂作用下仅发生反应CH3OCH3(g)+ O2(g)
O2(g) 2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=
2CO(g)+3H2(g),实验测得容器中压强与时间变化如图所示。则前2.0min内该反应速率v(CH3OCH3)=______ mol·min-1;该温度下其分压平衡常数Kp=______ (kPa)3.5(已知 =12.2)。
=12.2)。
(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为______ ,若消耗标准状况下5.6LO2,则理论上左右两室溶液质量变化的差为______ g。

(1)已知:①C(s)+
②C(s)+ H2O(g)=CO(g) +H2(g) ∆H2 =130 kJ/mol;
③CO(g)+ 2H2(g)=CH3OH(g) ∆H3=- 90.1 kJ/mol;
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4= -134 kJ/mol。
则CH3OCH3(g)+
(2)在恒温恒压条件下,化工生产上利用二甲醚与氧气为原料制备合成气,实际生产过程中常常添加一定量的水蒸气,其目的是

(3)某温度下,在VL的刚性容器中充入4.0molCH3OCH3、2.0molO2及2.0molH2O(g),在催化剂作用下仅发生反应CH3OCH3(g)+

(4)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为

20-21高三下·湖北武汉·阶段练习
类题推荐
二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1
CH3OH(g) ΔH1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=___________ kJ·mol-1。
(2)在不同温度下,按照相同物质的量投料,发生反应①。测得CO的平衡转化率与压强的关系如图甲所示。下列说法中正确的是___________ (填序号)。
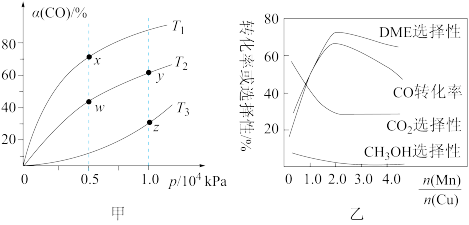
A.反应温度:T1>T2 B.混合气体密度:ρ(x)>ρ(w)
C.混合气体平均摩尔质量:M(y)<M(z) D.反应容器的容积关系:V(w)>2V(y)
(3)采用一种新型的催化剂(主要成分是CuMn合金),利用CO和H2制备二甲醚(DME)。由图乙可知,催化剂中 约为
约为___________ 时最有利于二甲醚的合成。
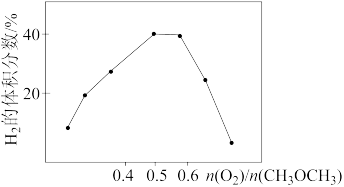
(4)恒温恒压条件下,化工生产上若利用二甲醚与氧气为原料制备合成气,反应方程式CH3OCH3(g)+1/2O2(g) 2CO(g)+3H2(g)。研究发现,所得平衡混合气体中H2的体积分数随
2CO(g)+3H2(g)。研究发现,所得平衡混合气体中H2的体积分数随
 (CH3OCH3)变化如图所示,试解释该曲线先变大后减小的原因
(CH3OCH3)变化如图所示,试解释该曲线先变大后减小的原因___________ 。
(5)高温时,二甲醚蒸气发生分解反应:CH3OCH3(g) CH4(g)+CO(g)+H2(g)。迅速将二甲醚引入一个504 ℃的抽成真空的恒容瓶中,在不同时刻测定瓶内压强p总如下表:
CH4(g)+CO(g)+H2(g)。迅速将二甲醚引入一个504 ℃的抽成真空的恒容瓶中,在不同时刻测定瓶内压强p总如下表:
①0—10min,CH4的反应速率为___________ kPa/min
②该反应达到平衡状态时,二甲醚的转化率为___________ 。
③该反应的平衡常数Kp=___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(6)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为___________ ,若消耗标准状况下5.6L O2,则理论上左右两室溶液质量变化的差值为___________ g。

①CO(g)+2H2(g)
②2CH3OH(g)
③CO(g)+H2O(g)
回答下列问题:
(1)反应3H2(g)+3CO(g)
(2)在不同温度下,按照相同物质的量投料,发生反应①。测得CO的平衡转化率与压强的关系如图甲所示。下列说法中正确的是

A.反应温度:T1>T2 B.混合气体密度:ρ(x)>ρ(w)
C.混合气体平均摩尔质量:M(y)<M(z) D.反应容器的容积关系:V(w)>2V(y)
(3)采用一种新型的催化剂(主要成分是CuMn合金),利用CO和H2制备二甲醚(DME)。由图乙可知,催化剂中
(4)恒温恒压条件下,化工生产上若利用二甲醚与氧气为原料制备合成气,反应方程式CH3OCH3(g)+1/2O2(g)

(5)高温时,二甲醚蒸气发生分解反应:CH3OCH3(g)
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| p总/kPa | 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
②该反应达到平衡状态时,二甲醚的转化率为
③该反应的平衡常数Kp=
(6)二甲醚燃料电池常采用磺酸类质子溶剂,其工作原理如图所示,则负极的电极反应式为

以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
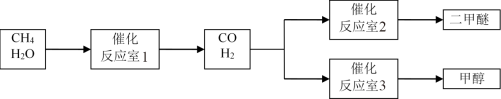
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____ 。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____ 。
(3)反应室1中发生反应:CH4(g)+H2O (g) CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______ mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______ v逆(填“>”、“<”或“=”)。
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________ 。

(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。

①该电池的正极反应式为_____ 。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________ L(标准状况)。

已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=
(3)反应室1中发生反应:CH4(g)+H2O (g)
 CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):| 反应时间/min | n(CH4)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是

(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。

①该电池的正极反应式为
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为
二甲醚(CH3OCH3)作为一种重要的化工原料和环保产品,在化工和医药行业中被广泛用作甲基化剂、气雾剂、制冷剂和各种有机合成原料。回答下列问题:
(1)合成气(CO、H2)一步合成二甲醚的反应为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)ΔH
已知:
①根据上述数据计算ΔH=_____ kJ·mol-1;该反应的活化能E正_____ E逆(填“>”“=”或“<”)。
②反应物投料比采用n(CO):n(H2)<1:2,则转化率α(CO)_____ α(H2)(填“>”“=”或“<”)。
(2)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。260℃或270℃时,CH3OCH3产率与CO转化率相差较大,合理的解释是_____ 。图中最高产率对应的温度为290℃,低于290℃时,二甲醚的产率_____ (填“是”或“不是”)对应温度下的平衡产率,判断理由是_____ 。

(3)二甲醚可以用甲醇脱水直接制备:2CH3OH(g)=CH3OCH3(g)+H2O(g)。某温度下,该反应的Kp=10,在密闭容器中通入一定量的CH3OH,反应到某时刻测得各组分的分压如下:
此时正、逆反应速率的大小:v正_______ v逆(填“>”“=”或“<”)。
(4)二甲醚直接燃料电池的工作原理如图所示:
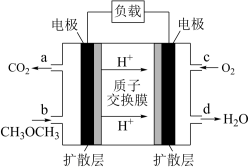
①该电池的负极反应式为_______ 。
②已知:能量利用率= ×100%。现利用该燃料电池电解水制备氢气,若消耗9.200g二甲醚,产生标准状况下的H217.92L,则能量利用率为
×100%。现利用该燃料电池电解水制备氢气,若消耗9.200g二甲醚,产生标准状况下的H217.92L,则能量利用率为_______ 。
(1)合成气(CO、H2)一步合成二甲醚的反应为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)ΔH
已知:
| 化学键 | H—H | H—O | C—H | C—O | C≡O |
| E(kJ•mol-1) | 436 | 463 | 413 | 343 | 1076 |
②反应物投料比采用n(CO):n(H2)<1:2,则转化率α(CO)
(2)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。260℃或270℃时,CH3OCH3产率与CO转化率相差较大,合理的解释是

(3)二甲醚可以用甲醇脱水直接制备:2CH3OH(g)=CH3OCH3(g)+H2O(g)。某温度下,该反应的Kp=10,在密闭容器中通入一定量的CH3OH,反应到某时刻测得各组分的分压如下:
| 物质 | CH3OCH3 | CH3OH | H2O |
| 压强/MPa | 0.75 | 0.25 | 0.25 |
(4)二甲醚直接燃料电池的工作原理如图所示:

①该电池的负极反应式为
②已知:能量利用率=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


