解答题-原理综合题 适中0.65 引用1 组卷348
不同价态含硫化合物的转化在工业上有重要的应用。回答下列问题:
I.利用NO2将SO2转化为SO3的反应过程如下:
i.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
ii.2NO(g)+O2(g)=2NO2(g) ΔH=-114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH=-197.7kJ·mol-1。则Q=_______ ;NO2的作用是_______ 。
II.某化学小组对反应2SO2(g)+O2(g) 2SO3(g)进行研究。
2SO3(g)进行研究。
(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是_______ (填标号)。
A.2υ(SO2)=υ(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
①表中a=_______ ,甲组实验在该条件下的平衡常数K=_______ 。
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正____ v逆(填“>”“=”或“<”),平衡时SO3的百分含量与原甲组实验相比__________ (填“变大”“变小”或“不变”)。
③为加快乙组实验的反应速率,下列措施可行的是_______ (填标号)。
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为绝热容器,则b值_______ (填“变大”“变小”或“不变”)。
I.利用NO2将SO2转化为SO3的反应过程如下:
i.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
ii.2NO(g)+O2(g)=2NO2(g) ΔH=-114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH=-197.7kJ·mol-1。则Q=
II.某化学小组对反应2SO2(g)+O2(g)
(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是
A.2υ(SO2)=υ(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
| 实验分组 | 甲组 | 乙组 |
| 反应物 | 2molSO2、1molO2 | 2molSO3 |
| 反应热量 | 放热158.16kJ | |
| 反应物的平衡转化率 | a | b |
①表中a=
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正
③为加快乙组实验的反应速率,下列措施可行的是
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为绝热容器,则b值
2021·云南昆明·二模
类题推荐
二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
(1)I:2SO2(g)+O2(g) 2SO3(g) ΔH1=-197.7kJ/mol K1(浓度平衡常数)
2SO3(g) ΔH1=-197.7kJ/mol K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O5催化剂的密闭容器装置:

在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2进行投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________ (用“甲、乙、丙”表示)。
(2)在容器丙中,0.1 MPa条件下,在不同温度或不同投料方式下研究上述反应,得到数据如下表:
①表中:a=___________ 。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=___________ MPa-1。
③451℃时,若按0.4 mol SO2、0.4mol O2、0.4 mol SO3进行投料,则反应开始时v正(SO2)___________ v逆(SO2)(填“>”、“<”或“=”)。
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g) SO3(g)+NO(g) △H2 K2(浓度平衡常数)
SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g) 2NO2(g) △H3=-114.1 kJ/mol K3(浓度平衡常数),△H2=
2NO2(g) △H3=-114.1 kJ/mol K3(浓度平衡常数),△H2=___________ ;K3=___________ (用含有K1、K2的表达式表示)。
(1)I:2SO2(g)+O2(g)
为研究该反应,某同学设计了以下三种已装固体V2O5催化剂的密闭容器装置:

在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2进行投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为
(2)在容器丙中,0.1 MPa条件下,在不同温度或不同投料方式下研究上述反应,得到数据如下表:
| 实验序号 | A组 | B组 | C组 |
| 反应温度 | 451℃ | 451℃ | 551℃ |
| 投料方式(按照SO2、O2、SO3的顺序) | 2 mol 、1mol、0 mol | 0mol 、0mol 、2mol | 2mol 、1mol 、0mol |
| 含硫化合物的转化 | 60% | b | c |
| 反应的热量变化 | 放热a | 吸热79.08kJ | 放热 |
| 压强平衡常数(Kp) | Kp1 | Kp1 | Kp2 |
①表中:a=
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=
③451℃时,若按0.4 mol SO2、0.4mol O2、0.4 mol SO3进行投料,则反应开始时v正(SO2)
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g)
Ⅲ:2NO(g)+O2(g)
2SO2(g)+O2(g)⇌2SO3(g),是工业制硫酸的主要反应之一、
(1)该反应过程的能量变化如图所示:
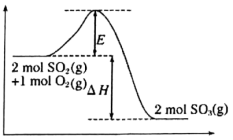
由图中曲线变化可知,该反应为_______ (填“放热”或“吸热”)反应。
(2)断开气态物质中1mol某种共价键生成气态原子需要吸收的能量称为键能(kJ·mol-1)。如表所示是一些共价键的键能。
根据上表的数据,在合成氨的热化学方程式_______
(3)在2L容器中投入2molSO2和bmolO2,下图是部分反应物与生成物随时间的变化曲线。
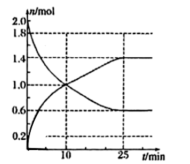
①10min时v(正)_______ v(逆)(填“大于”或“小于”或“等于”);0-10min内,v(SO3)=_______ 。
②反应达到最大限度的时间是_______ min,平衡时,SO2的转化率为_______
③下列条件能够加快反应速率的是_______ 。
A.升高温度
B.保持压强不变,充入He使容积增大
C.保持体积不变,充入He使压强增大
D.充入一定量的氧气。
④下列情况能说明该反应达到化学平衡的是_______ 。
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
E.SO2、O2、SO3的物质的量之比达到2:1:2
(1)该反应过程的能量变化如图所示:

由图中曲线变化可知,该反应为
(2)断开气态物质中1mol某种共价键生成气态原子需要吸收的能量称为键能(kJ·mol-1)。如表所示是一些共价键的键能。
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ·mol-1) | 436 | 946 | 391 |
根据上表的数据,在合成氨的热化学方程式
(3)在2L容器中投入2molSO2和bmolO2,下图是部分反应物与生成物随时间的变化曲线。

①10min时v(正)
②反应达到最大限度的时间是
③下列条件能够加快反应速率的是
A.升高温度
B.保持压强不变,充入He使容积增大
C.保持体积不变,充入He使压强增大
D.充入一定量的氧气。
④下列情况能说明该反应达到化学平衡的是
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
E.SO2、O2、SO3的物质的量之比达到2:1:2
SO2催化氧化制SO3是工业制硫酸的关键过程,其反应为2SO2(g)+O2(g) 2SO3(g) △H<0。实验室模拟合成SO3,向温度为400℃,容积为0.5L的恒容密闭容器中加入2molSO2和1molO2,反应过程中SO3浓度随时间变化情况见表。
2SO3(g) △H<0。实验室模拟合成SO3,向温度为400℃,容积为0.5L的恒容密闭容器中加入2molSO2和1molO2,反应过程中SO3浓度随时间变化情况见表。
(1)0~3min内SO2的平均反应速率为____ mol·L-1·min-1,5min后若改变某一条件使得SO3的浓度发生了如表所示的变化,则该条件为___ (填标号)。
A.升高温度 B.增大SO2浓度 C.移出部分SO3 D.降低温度 E.加入合适的催化剂
(2)判断该反应达到平衡状态的依据是____ (填标号)。
A.2v正(SO3)=v逆(O2)
B.气体的平均相对分子质量不再改变
C.气体的密度不再改变
(3)4min时保持其他条件不变,若再向容器中通入0.5molSO2和0.5molSO3,则平衡将向____ (填“正”或“逆”)反应方向移动。
(4)4min时保持其他条件不变,仅充入氮气,使体系压强增大,SO2转化率将___ (填“变大”、“变小”或“不变”)。
(5)若初始投料及其他条件不变,在温度为T2℃时进行反应,达到新平衡后,气体总压强是反应前的 ,则SO2的物质的量分数为
,则SO2的物质的量分数为____ ,T2℃时的平衡常数K为___ ,T2____ (填“=”或“<”)400℃。
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| SO3浓度/(mol·L-1) | 1.2 | 2.0 | 2.7 | 3.0 | 3.0 | 2.4 | 2.1 | 2.1 |
(1)0~3min内SO2的平均反应速率为
A.升高温度 B.增大SO2浓度 C.移出部分SO3 D.降低温度 E.加入合适的催化剂
(2)判断该反应达到平衡状态的依据是
A.2v正(SO3)=v逆(O2)
B.气体的平均相对分子质量不再改变
C.气体的密度不再改变
(3)4min时保持其他条件不变,若再向容器中通入0.5molSO2和0.5molSO3,则平衡将向
(4)4min时保持其他条件不变,仅充入氮气,使体系压强增大,SO2转化率将
(5)若初始投料及其他条件不变,在温度为T2℃时进行反应,达到新平衡后,气体总压强是反应前的
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


