CO、CO2、CH4等含碳化合物的综合利用是当今科技的重点研究对象之一。
(1)双功能催化剂的催化作用,突破了低温下水煤气转换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]时高转化率与高反应速率不能兼得的难题。反应过程示意图如下:

下列说法正确的是
A.过程I、过程II、过程皿均为吸热反应
B.图示的三个过程都与H2O有关
C.图示的三个过程中均有极性共价键的断裂和生成
D.使用催化剂降低了整个水煤气变换反应过程的ΔH
(2)已知:
①2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH=+180kJ·mol-1
表示CO燃烧热的热化学方程式为
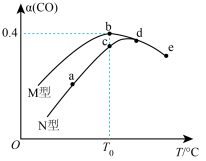
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2(g)=2CO2(g),向容积相同的恒容密闭容器中分别充入等物质的量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(α)如图所示。

①图中a、b、c、d、e五个点对应状态下,反应速率最慢的是
②N型催化剂条件下,从a点到e点,CO的转化率先增大,后减小,e点时突然减小的原因为
③若b点容器中c(O2)=0.4mol·L-1,则T℃时该反应的平衡常数K=
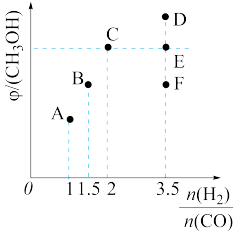
(4)在一定条件下,CH4(g)+CO2(g)=2H2(g)+2CO(g),可制得合成气H2和CO。在2L密闭容器中充入CO2和CH4,使其物质的量浓度均为0.5mol·L-1,达到平衡时CO的体积分数为X,若恒温恒容下,向平衡体系中再充入1mol CO2和1mol CH4。回答下列问题:
①化学平衡
②再次平衡时,CO的体积分数
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网