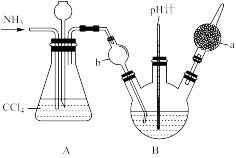解答题-实验探究题 较难0.4 引用1 组卷179
九天揽月探广寒,嫦娥携宝返神舟,我国探月工程取得重大成果。高氯酸铵( )是运载火箭推进剂的重要成分,其在一定条件下分解产生
)是运载火箭推进剂的重要成分,其在一定条件下分解产生 (g)和
(g)和 、
、 、
、 。三种单质气体。
。三种单质气体。
(1)某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,检查装置的气密性,装入试剂,通干燥的惰性气体排尽装置内的空气,将导管末端移入盛满水的试管,通入气体产物。(已知:焦性没食子酸溶液可吸收氧气)
①装置A用于检验分解产物中的 (g),则A中盛放的试剂为
(g),则A中盛放的试剂为_______ 。
②品红溶液的作用是_______ ,E装置硬质玻璃管中的现象是_______ 。
③G装置试管中收集到的气体是_______ 。
(2)研究小组通过甲醛(HCHO)法测定某样品中 的质量分数。已知:
的质量分数。已知: 的相对分子质量为117.5;
的相对分子质量为117.5; 与甲醛反应的离子方程式为:
与甲醛反应的离子方程式为:


实验步骤:准确称取3.1250g样品溶于水配制成250mL溶液,量取25.00mL样品溶液于锥形瓶中,加入过量中性甲醛溶液(甲醛与NaOH不反应),摇匀、静置5min后,加入1~2滴酚酞试液用0. 1000 NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
①标准溶液应盛放在下图装置_______ 中(填“Ⅰ”或“Ⅱ”),达到滴定终点的现象是_______ 。
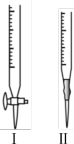
②该样品中 的质量分数为
的质量分数为_______ 。
(1)某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,检查装置的气密性,装入试剂,通干燥的惰性气体排尽装置内的空气,将导管末端移入盛满水的试管,通入气体产物。(已知:焦性没食子酸溶液可吸收氧气)

①装置A用于检验分解产物中的
②品红溶液的作用是
③G装置试管中收集到的气体是
(2)研究小组通过甲醛(HCHO)法测定某样品中
实验步骤:准确称取3.1250g样品溶于水配制成250mL溶液,量取25.00mL样品溶液于锥形瓶中,加入过量中性甲醛溶液(甲醛与NaOH不反应),摇匀、静置5min后,加入1~2滴酚酞试液用0. 1000
①标准溶液应盛放在下图装置

②该样品中
20-21高二上·贵州六盘水·期末
类题推荐
高氯酸铵 为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
为白色晶体,分解时产生大量气体,是复合火箭推进剂的重要成分。
 高氯酸铵中氯元素的化合价为
高氯酸铵中氯元素的化合价为_____________ 。
 高氯酸铵在高温条件下分解会产生H
高氯酸铵在高温条件下分解会产生H 和三种单质气体,请写出该分解反应的化学方程式
和三种单质气体,请写出该分解反应的化学方程式____________________________ 。
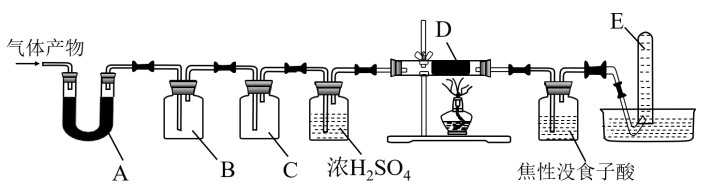
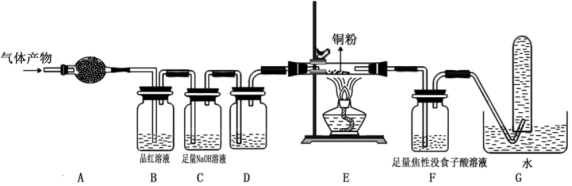
 某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。
某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,依次检查装置的气密性、装入试剂、通干燥的惰性气体排尽装置内的空气、将导管末端移入盛满水的试管E、通入气体产物。 已知:焦性没食子酸溶液用于吸收氧气
已知:焦性没食子酸溶液用于吸收氧气
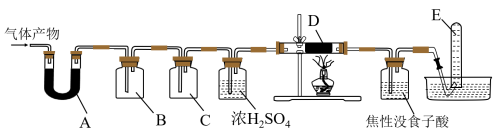
 装置A、B、C、D中盛放的药品可以依次为
装置A、B、C、D中盛放的药品可以依次为__________  选填序号:Ⅰ、Ⅱ或Ⅲ
选填序号:Ⅰ、Ⅱ或Ⅲ 。
。
Ⅰ 碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
碱石灰、湿润的淀粉KI试纸、氢氧化钠溶液、Cu
Ⅱ 无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
无水硫酸铜、湿润的红色布条、氢氧化钠溶液、Cu
Ⅲ 无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
无水硫酸铜、湿润的淀粉KI试纸、饱和食盐水、Cu
 装置E收集到的气体可能是
装置E收集到的气体可能是_____________  填化学式
填化学式 。
。
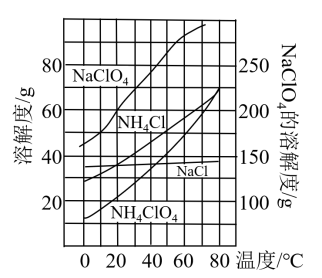
 经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq)
经查阅资料,该小组利用反应NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)在实验室制取
NH4ClO4(aq)+NaCl(aq)在实验室制取 ,该反应中各物质的溶解度随温度的变化曲线如图。
,该反应中各物质的溶解度随温度的变化曲线如图。
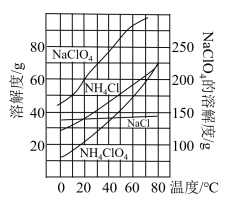
 从混合溶液中获得较多粗NH
从混合溶液中获得较多粗NH ClO
ClO 晶体的实验操作依次为
晶体的实验操作依次为________ 、_________ 和过滤、洗涤、干燥。
 研究小组分析认为,若用氨气和浓盐酸代替NH
研究小组分析认为,若用氨气和浓盐酸代替NH Cl,则上述反应不需要外界供热就能进行,其原因是
Cl,则上述反应不需要外界供热就能进行,其原因是_______________________________ 。
 研究小组通过甲醛法测定所得产品NH
研究小组通过甲醛法测定所得产品NH ClO
ClO 的质量分数。
的质量分数。 已知:NH
已知:NH ClO
ClO 的相对分子质量为
的相对分子质量为 ;NH
;NH ClO
ClO 与甲醛反应的离子方程式为
与甲醛反应的离子方程式为 ,
, N
N H
H

 N
N

实验步骤:
步骤Ⅰ 称取
称取 样品。
样品。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取
移取 样品溶液于250mL锥形瓶中,加入
样品溶液于250mL锥形瓶中,加入 的中性甲醛溶液
的中性甲醛溶液 过量
过量 ,摇匀、静置5min后,加入
,摇匀、静置5min后,加入 滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复
滴酚酞试液,用NaOH标准溶液滴定至终点。记录数据。重复 滴定
滴定 操作2次。
操作2次。
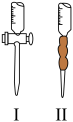
 标准液应盛放在上图装置
标准液应盛放在上图装置_________  填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ” 中,判断达到滴定终点的现象是
中,判断达到滴定终点的现象是__________ 。
 滴定结果如下表所示:
滴定结果如下表所示:
则所用标准溶液的体积为___________ mL,若NaOH标准溶液的浓度为 ,则该产品中
,则该产品中 的质量分数为
的质量分数为_____________ 。

Ⅰ
Ⅱ
Ⅲ


实验步骤:
步骤Ⅰ
步骤Ⅱ
步骤Ⅲ

| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度 | 滴定后刻度 | |
| 1 | ||
| 2 | ||
| 3 | ||
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网