解答题-原理综合题 较难0.4 引用1 组卷176
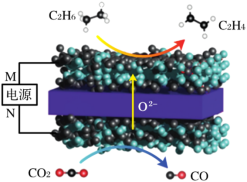
将CO2转化成C2H4可以变废为宝、改善环境。以CO2、C2H6为原料合成C2H4涉及的主要反应如下:
C2H6(g)=CH4(g)+H2(g)+C(s) △H=+9kJ•mol-1
C2H4(g)+H2(g)=C2H6(g) △H=-136kJ•mol-1
H2(g)+CO2(g)=H2O(g)+CO(g) △H=+41kJ•mol-1
(1)CO2、C2H6为原料合成C2H4的主要反应CO2(g)+C2H6(g)=C2H4(g)+H2O(g)+CO(g)△H=__ ;任意写出两点加快该反应速率的方法:__ 、___ 。
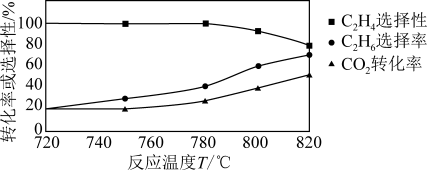
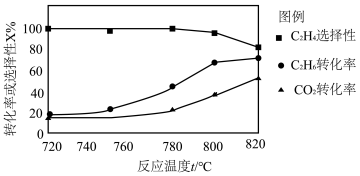
(2)0.1MPa时向密闭容器中充入CO2和C2H6,发生反应CO2(g)+C2H6(g)=C2H4(g)+H2O(g)+CO(g),温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示:
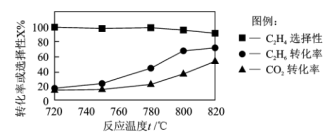
①工业生产综合各方面的因素,反应选择800℃的原因是___ 。
②C2H6的转化率随着温度的升高始终高于CO2的原因是___ 。
③800℃时,随着 的比值增大,CO2转化率将
的比值增大,CO2转化率将__ (填“增大”或“减小”)。
(3)在800℃时,n(CO2):n(C2H6)=1:3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应CO2(g)+C2H6(g)=C2H4(g)+H2O(g)+CO(g),初始压强为P0,一段时间达到平衡,产物的物质的量分数之和与剩余反应物的物质的量分数之和相等,该温度下反应的平衡常数Kp__ P0(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用最简分式表示)。
C2H6(g)=CH4(g)+H2(g)+C(s) △H=+9kJ•mol-1
C2H4(g)+H2(g)=C2H6(g) △H=-136kJ•mol-1
H2(g)+CO2(g)=H2O(g)+CO(g) △H=+41kJ•mol-1
(1)CO2、C2H6为原料合成C2H4的主要反应CO2(g)+C2H6(g)=C2H4(g)+H2O(g)+CO(g)△H=
(2)0.1MPa时向密闭容器中充入CO2和C2H6,发生反应CO2(g)+C2H6(g)=C2H4(g)+H2O(g)+CO(g),温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示:

①工业生产综合各方面的因素,反应选择800℃的原因是
②C2H6的转化率随着温度的升高始终高于CO2的原因是
③800℃时,随着
(3)在800℃时,n(CO2):n(C2H6)=1:3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应CO2(g)+C2H6(g)=C2H4(g)+H2O(g)+CO(g),初始压强为P0,一段时间达到平衡,产物的物质的量分数之和与剩余反应物的物质的量分数之和相等,该温度下反应的平衡常数Kp
20-21高三上·河北保定·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网