解答题-实验探究题 适中0.65 引用2 组卷396
氧钒(IV)碱式碳酸铵晶体化学式为:(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,实验室以V2O5为原料制备该晶体的流程如图:
V2O5 VOCl2溶液
VOCl2溶液 氧钒(IV)碱式碳酸铵晶体
氧钒(IV)碱式碳酸铵晶体
(1)N2H4的电子式是_______ 。若“还原”后其它产物均绿色环保,写出该反应的化学方程式_______  。
。
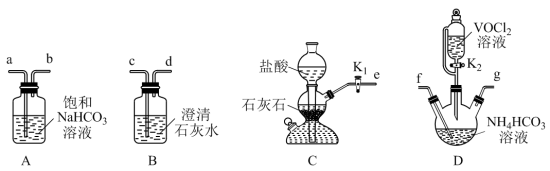
(2)“转化”可在如图装置中进行。(已知VO2+能被O2氧化)
①仪器M的名称是_______ 。使A中制气反应停止的操作是_______ 。
②装置C中将VOCl2转化并得到产品,实验操作顺序为:打开活塞a→_______ →_______ →_______ .(填标号)。
I.取下P(如图),锥形瓶口塞上橡胶塞
II.将锥形瓶置于干燥器中,静置后过滤
III.打开活塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全
③得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是_______ (填离子符号),用乙醚洗涤的目的是_______ 。
④称量mg产品于锥形瓶中,先将产品中钒元素转化为VO ,消除其它干扰,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为VmL(已知滴定反应为VO
,消除其它干扰,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为VmL(已知滴定反应为VO +Fe2++2H+=VO2++Fe3++H2O).则产品中钒的质量分数为
+Fe2++2H+=VO2++Fe3++H2O).则产品中钒的质量分数为_______ (以VO2+的量进行计算,列出计算式)。
V2O5
(1)N2H4的电子式是
 。
。(2)“转化”可在如图装置中进行。(已知VO2+能被O2氧化)

①仪器M的名称是
②装置C中将VOCl2转化并得到产品,实验操作顺序为:打开活塞a→
I.取下P(如图),锥形瓶口塞上橡胶塞
II.将锥形瓶置于干燥器中,静置后过滤
III.打开活塞b,加入VOCl2溶液,持续搅拌一段时间,使反应完全
③得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是
④称量mg产品于锥形瓶中,先将产品中钒元素转化为VO
2021·湖北·模拟预测
类题推荐
氧钒(IV)碱式碳酸铵晶体化学式为: ,实验室以
,实验室以 为原料制备该晶体的流程如图:
为原料制备该晶体的流程如图:

(1)若“还原”后其它产物均绿色环保,写出该反应的化学方程式___________ 。
(2)“转化”可在如图装置中进行。(已知 能被
能被 氧化)
氧化)
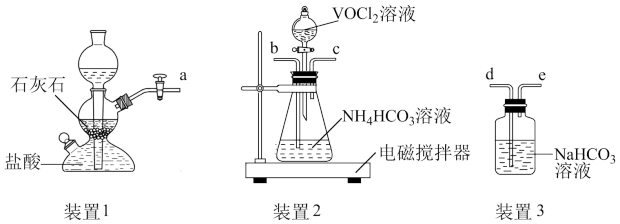
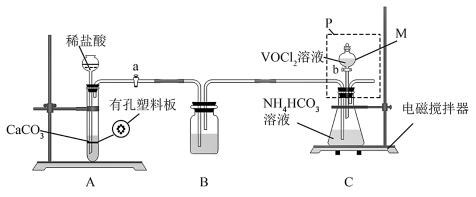
①上述装置依次连接的合理顺序为___________ (填字母)。
②加入 前需要进行的操作是
前需要进行的操作是___________ 。
③装置2中将 转化并得到产品,实验操作顺序为:________→_______→_______→_______→B→F→D→抽干称重(填标号)。
转化并得到产品,实验操作顺序为:________→_______→_______→_______→B→F→D→抽干称重(填标号)。___________ 。
A.取下分液漏斗,将锥形瓶瓶口换上橡胶塞
B.用饱和 溶液洗涤晶体3次
溶液洗涤晶体3次
C.将锥形瓶置于干燥器中,静置后过滤
D.用乙醚洗涤2次
E.打开分液漏斗活塞,加入 溶液
溶液
F.用无水乙醇洗涤2次
G.打开活塞a
④用饱和 溶液洗涤晶体,检验晶体已洗涤干净的操作是
溶液洗涤晶体,检验晶体已洗涤干净的操作是___________ 。
(3)为测定粗产品的纯度,进行如下实验:分别称量三份ag产品于三只锥形瓶中,每份分别用20mL蒸馏水与30mL稀硫酸溶解后,加入0.0200mol/L 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量NaNO2,最后用0.100mol/L
溶液至稍过量,再用尿素除去过量NaNO2,最后用0.100mol/L 标准溶液分别滴定至终点,消耗标准溶液的体积如下表所示。(
标准溶液分别滴定至终点,消耗标准溶液的体积如下表所示。( )
)
粗产品中钒的质量分数为___________ (假设V的相对原子质量为M)。

(1)若“还原”后其它产物均绿色环保,写出该反应的化学方程式
(2)“转化”可在如图装置中进行。(已知

①上述装置依次连接的合理顺序为
②加入
③装置2中将
A.取下分液漏斗,将锥形瓶瓶口换上橡胶塞
B.用饱和
C.将锥形瓶置于干燥器中,静置后过滤
D.用乙醚洗涤2次
E.打开分液漏斗活塞,加入
F.用无水乙醇洗涤2次
G.打开活塞a
④用饱和
(3)为测定粗产品的纯度,进行如下实验:分别称量三份ag产品于三只锥形瓶中,每份分别用20mL蒸馏水与30mL稀硫酸溶解后,加入0.0200mol/L
| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 第一份 | 0.00 | 19.98 |
| 第二份 | 1.20 | 22.40 |
| 第三份 | 1.56 | 21.58 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网