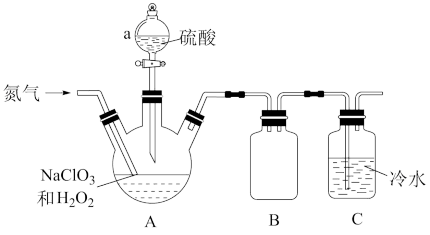
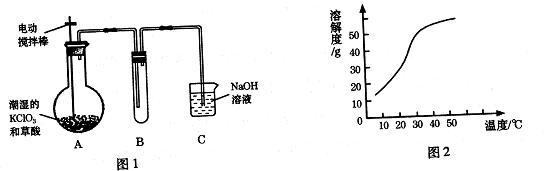
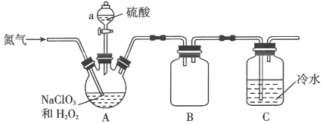
解答题-工业流程题 适中0.65 引用1 组卷76
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如图:
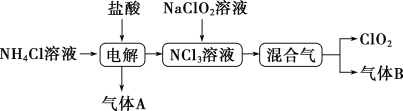
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自燃爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为__ 。实验室制备气体B的化学方程式为__ 。为保证实验的安全,在电解时需注意的问题是:
①控制好生成NCl3的浓度;
②_______ 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为__ 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样;
步骤2:量取V1mL试样加入锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30min;
步骤3:以淀粉溶液做指示剂,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知I2+2S2O =2I-+S4O
=2I-+S4O )
)
①上述步骤3中滴定终点的现象是__ 。
②根据上述步骤可计算出原ClO2溶液的浓度为___ g /L(用含字母的代数式表示)

已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自燃爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为
①控制好生成NCl3的浓度;
②
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样;
步骤2:量取V1mL试样加入锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30min;
步骤3:以淀粉溶液做指示剂,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知I2+2S2O
①上述步骤3中滴定终点的现象是
②根据上述步骤可计算出原ClO2溶液的浓度为
20-21高三上·安徽六安·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网