解答题-工业流程题 较难0.4 引用1 组卷214
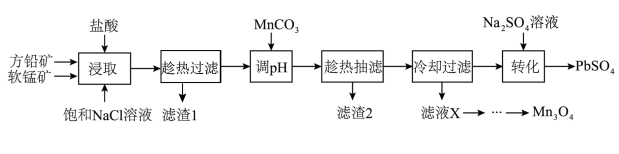
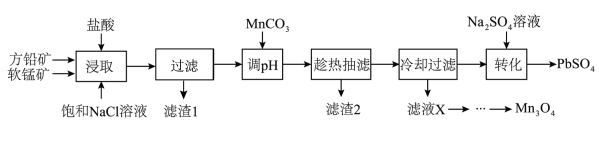
方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:
已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)⇌ (aq) ΔH>0
(aq) ΔH>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3·H2O=2Mn3O4↓+12NH4Cl+6H2O
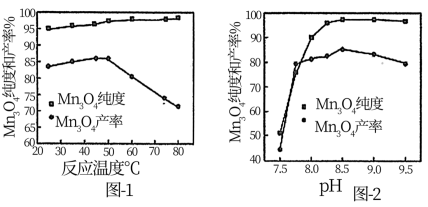
(1)根据图象分析,“浸取”过程反应的最佳条件是_______ 。
(2)请从化学平衡移动的角度分析加入饱和NaCl溶液的目的是_______ 。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为_______ 。
(4)加入物质A可用于调节酸浸液的pH值,使有些金属离子转化为沉淀,物质A可以是__ (填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
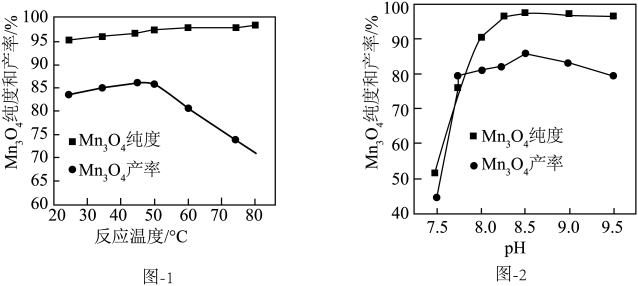
(5)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图-1、图-2所示,请补充完整由滤液X制备Mn3O4的实验方案:_______ ,真空干燥4小时得产品Mn3O4.(实验中须使用的试剂:氨水、空气)

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)⇌
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3·H2O=2Mn3O4↓+12NH4Cl+6H2O
(1)根据图象分析,“浸取”过程反应的最佳条件是

(2)请从化学平衡移动的角度分析加入饱和NaCl溶液的目的是
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为
(4)加入物质A可用于调节酸浸液的pH值,使有些金属离子转化为沉淀,物质A可以是
A.MnCO3 B.NaOH C.ZnO D.PbO
(5)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图-1、图-2所示,请补充完整由滤液X制备Mn3O4的实验方案:

20-21高三下·江苏苏州·阶段练习
类题推荐
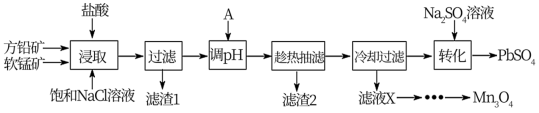
用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:
已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3•H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L−1计算)。
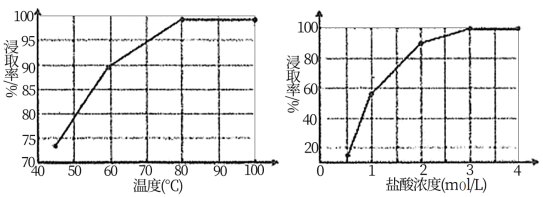
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______ 。
(2)加入饱和NaCl溶液的目的是______ 。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______ 。
(4)用MnCO3调节溶液pH的范围为______ 。
(5)“趁热抽滤”的目的是______ 。
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图−1、图−2所示,请补充完整由滤液X制备Mn3O4的实验方案:______ ,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)


已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq)
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3•H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L−1计算)。
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
| 沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(2)加入饱和NaCl溶液的目的是
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为
(4)用MnCO3调节溶液pH的范围为
(5)“趁热抽滤”的目的是
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图−1、图−2所示,请补充完整由滤液X制备Mn3O4的实验方案:

以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4液和Mn3O4,主要实验步骤如下
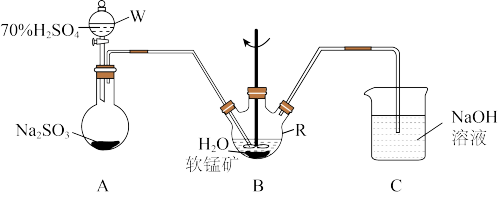
步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是_______ 。
(2)装置A用于制取SO2,反应的化学方程式为_________ 。
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是______________ 。
(4)装置C的作用是______________________ 。
(5)“步骤Ⅱ”中加入纯净MnO2的目的是_______________ ,用MnCO3调节溶液pH时,需调节溶液pH的范围为________ (该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表)
(6)已知①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示
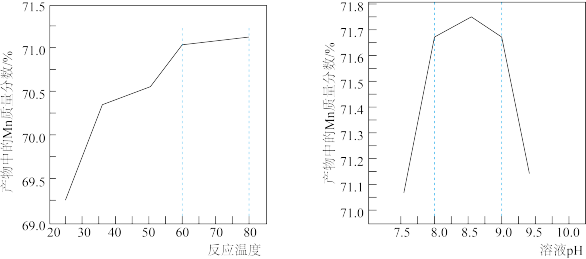
②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:______________________ ,真空干燥6小时得产品Mn3O4。

步骤I、如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2=MnSO4)。
步骤II、充分反应后,在不断搅拌下依次向仪器R中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅,
步骤III、过滤得MnSO4溶液
(1)仪器R的名称是
(2)装置A用于制取SO2,反应的化学方程式为
(3)装置B中的反应应控制在90~100℃,适宜的加热方式是
(4)装置C的作用是
(5)“步骤Ⅱ”中加入纯净MnO2的目的是
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀的pH | 7.04 | 1.87 | 3.32 | 7.56 |
| 沉淀完全的pH | 9.18 | 3.27 | 4.9 | 10.2 |

②反应温度超过80℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网