解答题-原理综合题 适中0.65 引用1 组卷163
纳米级Cu2O由于具有优良的催化性能而受到关注。
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol
②C+1/2O2(g)=CO(g) △H=-110.5kJ/mol
③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol
用炭粉在高温条件下还原CuO的方法制得纳米级Cu2O的热化学方程式为______ 。
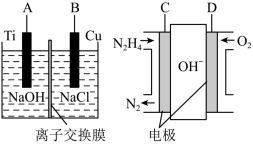
(2)采用离子交换膜控制电解液中OH-的浓度也可以制备纳米级Cu2O,装置如下图所示:

为保证电解能持续稳定进行,若电解槽中的离子交换膜只允许一种离子通过,则该交换膜应为____ (填“Na+”或“H+”或“OH-”)离子交换膜,该电池的阳极反应式为___ 。
(3)用Cu2O做催化剂,工业上在一定条件下,可以用一氧化碳与氢气反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
①如图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应到3分钟用H2浓度变化表示平均反应速率v(H2)=______ (保留两位小数)。
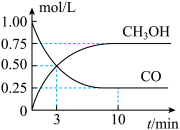
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则该反应在该温度下的平衡常数为______ (保留一位有效数字)。相同温度下,若向上述2L密闭容器中加入4molCO、3molH2、1molCH3OH,反应开始时,v(正)______ v(逆)(填“大于”、“小于”或“等于”)。
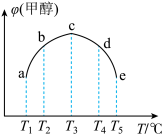
③在容积均为1L的a、b、c、d、e,5个密闭容器中都分别充入1molCO和2molH2的混合气体,控温。图表示5个密闭容器温度分别为T1~T5、反应均进行到5min时甲醇的体积分数,要使容器c中的甲醇体积分数减少,可采取的措施有______ (写一个即可),此条件下该反应的平衡常数K______ (填“增大”、“不变”或“减小”)。
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol
②C+1/2O2(g)=CO(g) △H=-110.5kJ/mol
③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol
用炭粉在高温条件下还原CuO的方法制得纳米级Cu2O的热化学方程式为
(2)采用离子交换膜控制电解液中OH-的浓度也可以制备纳米级Cu2O,装置如下图所示:

为保证电解能持续稳定进行,若电解槽中的离子交换膜只允许一种离子通过,则该交换膜应为
(3)用Cu2O做催化剂,工业上在一定条件下,可以用一氧化碳与氢气反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
①如图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应到3分钟用H2浓度变化表示平均反应速率v(H2)=

②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则该反应在该温度下的平衡常数为
③在容积均为1L的a、b、c、d、e,5个密闭容器中都分别充入1molCO和2molH2的混合气体,控温。图表示5个密闭容器温度分别为T1~T5、反应均进行到5min时甲醇的体积分数,要使容器c中的甲醇体积分数减少,可采取的措施有

19-20高三下·天津武清·开学考试
类题推荐
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是______________ 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =__________ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为________________ 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为____________ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O 2H2(g)+O2(g) ΔH>0
2H2(g)+O2(g) ΔH>0
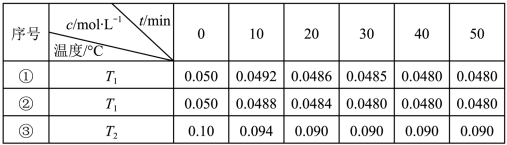
水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是________ (填字母代号)。
A.实验温度: T12
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂效率低
D.T2条件下该反应的化学平衡常数为6.17×10-5mol/L
(6)25℃时,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L盐酸,生成沉淀,若已知Kap(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=______________ 。(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL 0.01mol/L盐酸,是否继续产生沉淀_______ (填“是”或“否”)。
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O
 2H2(g)+O2(g) ΔH>0
2H2(g)+O2(g) ΔH>0水蒸气的浓度随时间t变化如下表所示。
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是
A.实验温度: T12
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂效率低
D.T2条件下该反应的化学平衡常数为6.17×10-5mol/L
(6)25℃时,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L盐酸,生成沉淀,若已知Kap(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__ 而使Cu2O产率降低。
(2)已知:
①2Cu(s)+ O2(g)
O2(g) Cu2O(s) ΔH1=-169 kJ·mol-1
Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ O2(g)
O2(g) CO(g) ΔH2=-110.5 kJ·mol-1
CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+ O2(g)
O2(g) CuO(s) ΔH3=-157 kJ·mol-1
CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H=________ 。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
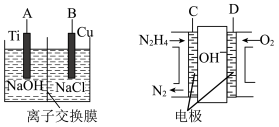
①上述装置中B电极应连_________ 电极(填“C”或“D”)。
②该离子交换膜为____ 离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______ 。
③原电池中负极反应式为______________ 。
(4)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O(g) 2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
①催化剂的催化效率:实验①_______ 实验②(填“>”或“<”)。
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为________ 。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成
(2)已知:
①2Cu(s)+
 Cu2O(s) ΔH1=-169 kJ·mol-1
Cu2O(s) ΔH1=-169 kJ·mol-1②C(s)+
 CO(g) ΔH2=-110.5 kJ·mol-1
CO(g) ΔH2=-110.5 kJ·mol-1③Cu(s)+
 CuO(s) ΔH3=-157 kJ·mol-1
CuO(s) ΔH3=-157 kJ·mol-1则方法a中发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H=
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:

①上述装置中B电极应连
②该离子交换膜为
③原电池中负极反应式为
(4)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O(g)
 2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:| 序号 | 温度/℃c/mol·L-1t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
| ② | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
| ③ | T2 | 0.10 | 0.096 | 0.093 | 0.090 | 0.090 | 0.090 |
①催化剂的催化效率:实验①
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网