单选题 适中0.65 引用2 组卷536
甲醇—水蒸气重整法所得氢气是电动汽车燃料电池的理想氢源。反应的热化学方程式如下:
反应Ⅰ

反应Ⅱ

 会损害燃料电池的交换膜。在压强、
会损害燃料电池的交换膜。在压强、 和
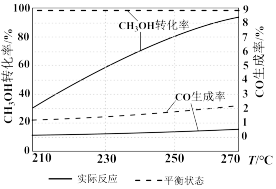
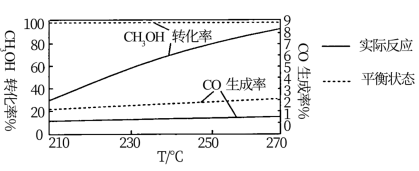
和 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下,
的起始浓度一定的条件下,催化反应相同时间,测得不同温度下, 的转化率、
的转化率、 的产率和
的产率和 的物质的量如图中实线所示(图中虚线表示相同条件下达平衡状态时的变化)。已知:
的物质的量如图中实线所示(图中虚线表示相同条件下达平衡状态时的变化)。已知: 的选择性
的选择性 。下列说法正确的是
。下列说法正确的是

反应Ⅰ
反应Ⅱ

| A. |
| B.210℃升温至270℃时,反应Ⅰ的活化能增大 |
| C.温度升高,反应Ⅰ的速率比反应Ⅱ增加的更多 |
| D.温度升高,n(CO)的实际值与平衡值相差越来越大,原因是催化剂对CO的选择性升高 |
20-21高三下·江苏扬州·开学考试
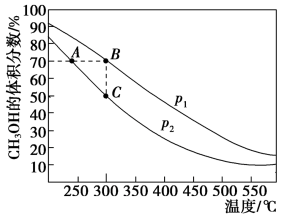
类题推荐  催化加氢合成
催化加氢合成 能实现碳的循环利用。一定压强下,
能实现碳的循环利用。一定压强下, 与
与 在密闭容器中发生的主要反应为:
在密闭容器中发生的主要反应为:
Ⅰ:

Ⅱ:

反应相同时间,测得不同温度下 转化率和
转化率和 选择性如题图实验值所示。图中平衡值表示在相同条件下达到平衡状态时
选择性如题图实验值所示。图中平衡值表示在相同条件下达到平衡状态时 转化率和
转化率和 选择性随温度的变化。[
选择性随温度的变化。[ ]
]
下列说法不 正确的是

Ⅰ:
Ⅱ:
反应相同时间,测得不同温度下
下列说法

| A.该测定实验体系未达到化学平衡状态 |
| B.相同条件下,压缩容器体积能提高 |
| C.相同温度下, |
| D.260~280℃, |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网