解答题-原理综合题 较易0.85 引用3 组卷218
CO2引起的气候变化已经引起了全世界的关注,但同时CO2也是时持续的碳资源,将CO2转化为高附加值的燃料或化学品不仅可以解决CO2的问题,还可变废为宝得到有用的化学品。CO2加氢制甲醇是实现这一过程的理想选择之一、
(1)CO2加氢制甲醇的化学方程式是:CO2(g)+3H2(g) CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
CH3OH(l)+H2O(l) ∆H, 相关物质的燃烧热数据如下表所示:
回答下列问题:
①∆H=___________ kJ∙mol−1
②320℃时,将含CO2体积分数10%的空气与H2按体积比5:2投入到密闭容器中,同时加入催化剂发生反应(此时体系内各物质均为气态),测得初始时压强为P,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为___________ ,反应的平衡常数___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)Fujta等学者开展了在Cu/ZnO催化剂上进行CO2+H2合成甲醇机理的研究。机理如下:
①过程3的化学方程式为___________ ; 研究表明,过程3的活化能小但实际反应速率慢,是控速步骤,导致该步反应速率小的原因可能是___________ 。
A.H2O对该反应有阻碍作用 B. CO2的存在削弱了同一吸附位上H2的吸附
C.温度变化导致活化能增大 D.温度变化导致平衡常数减小
②ZnO也有催化作用,催化机理与Cu相似,CH3O−Zn与___________ 反应可获得CH3OH。
(3)科学家设计了一种新的CO2−H2O可循环系统,可以实现温室气体的零排放,同时也回避了H2的难储存问题,装置如下:
①系统中的能量转化形式有___________ 。
②b电极上的电极反应式为___________ ,如果将电解质溶液换为KOH溶液,对合成甲醇造成的不良后果是___________ 。
(1)CO2加氢制甲醇的化学方程式是:CO2(g)+3H2(g)
| 物质 | H2(g) | CH3OH(1) |
| 燃烧热△H (kJ∙mol−1) | −284 | −726 |
①∆H=
②320℃时,将含CO2体积分数10%的空气与H2按体积比5:2投入到密闭容器中,同时加入催化剂发生反应(此时体系内各物质均为气态),测得初始时压强为P,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为
(2)Fujta等学者开展了在Cu/ZnO催化剂上进行CO2+H2合成甲醇机理的研究。机理如下:
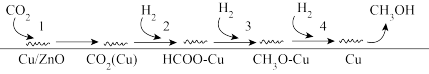
①过程3的化学方程式为
A.H2O对该反应有阻碍作用 B. CO2的存在削弱了同一吸附位上H2的吸附
C.温度变化导致活化能增大 D.温度变化导致平衡常数减小
②ZnO也有催化作用,催化机理与Cu相似,CH3O−Zn与
(3)科学家设计了一种新的CO2−H2O可循环系统,可以实现温室气体的零排放,同时也回避了H2的难储存问题,装置如下:
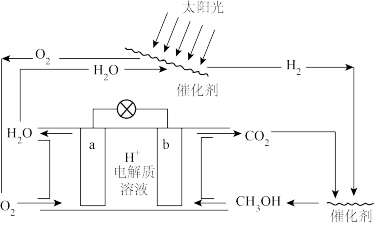
①系统中的能量转化形式有
②b电极上的电极反应式为
2021·新疆·模拟预测
类题推荐  是当今最主要的温室气体,全球各国都面临着严峻的减排压力。与此同时,
是当今最主要的温室气体,全球各国都面临着严峻的减排压力。与此同时, 也是一种“碳源”,转化为高附加值的燃料或化学品不仅可以解决
也是一种“碳源”,转化为高附加值的燃料或化学品不仅可以解决 的问题,还可变废为宝得到有用的化学品。
的问题,还可变废为宝得到有用的化学品。 加氢制甲醇是实现这一过程的理想方法之一。
加氢制甲醇是实现这一过程的理想方法之一。
主要发生以下反应:
反应I:

反应Ⅱ:

反应Ⅲ:

(1)已知部分化学键的键能如下表,则x=___________ 
(2)Fujta等学者开展了在Cu/ZnO催化剂上进行CO2+H2合成甲醇机理的研究。机理如下:

①过程2的化学方程式为___________ ;
②研究表明,过程3的活化能小但实际反应速率慢,是速控步骤,导致该步反应速率小的原因可能是___________
A.温度变化导致活化能增大
B. 的存在削弱了同一吸附位上
的存在削弱了同一吸附位上 的吸附
的吸附
C. 对该反应有阻碍作用
对该反应有阻碍作用
D.温度变化导致平衡常数减小
(3)一定温度下,在容积恒定的密闭容器中充入amol (g)和3amol
(g)和3amol (g),起始压强为
(g),起始压强为 在达到平衡,测得容器内的压强为起始的0.8倍,
在达到平衡,测得容器内的压强为起始的0.8倍, (g)的物质的量为0.6amol。在此条件下,
(g)的物质的量为0.6amol。在此条件下, 的转化率=
的转化率=________ ,反应Ⅲ的平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(4)甲醇水蒸气重整制氢(SRM)系统可作为电动汽车燃料电池的理想氢源。系统中的两个反应如下:
主反应:

副反应:

单位时间内, 转化率与CO生成率随温度的变化如图所示:
转化率与CO生成率随温度的变化如图所示:

升温过程中 实际反应转化率不断接近平衡状态转化率的原因是
实际反应转化率不断接近平衡状态转化率的原因是___________ ;温度升高,CO实际反应生成率并没有不断接近平衡状态的生成率,其原因可能是___________ 。
主要发生以下反应:
反应I:
反应Ⅱ:
反应Ⅲ:
(1)已知部分化学键的键能如下表,则x=
| 化学键 | H-H | H-O | C-H | 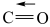 | C-O |
| 键能/( | 436 | 465 | 413 | 1076.8 | x |

①过程2的化学方程式为
②研究表明,过程3的活化能小但实际反应速率慢,是速控步骤,导致该步反应速率小的原因可能是
A.温度变化导致活化能增大
B.
C.
D.温度变化导致平衡常数减小
(3)一定温度下,在容积恒定的密闭容器中充入amol
(4)甲醇水蒸气重整制氢(SRM)系统可作为电动汽车燃料电池的理想氢源。系统中的两个反应如下:
主反应:
副反应:
单位时间内,

升温过程中
碳达峰、碳中和是近年来世界各国研究的重要课题,合理利用 ,对减少
,对减少 的排放及解决能源短缺问题具有重大意义。回答下列问题:
的排放及解决能源短缺问题具有重大意义。回答下列问题:
(1)利用 催化氢化制甲烷的反应为
催化氢化制甲烷的反应为
 。已知部分化学键的键能数据如表所示:
。已知部分化学键的键能数据如表所示:
则该反应的反应热
_______ 。
(2)Fujta等学者开展了在 催化剂上进行
催化剂上进行 和
和 合成甲醇机理的研究。机理如下:
合成甲醇机理的研究。机理如下:
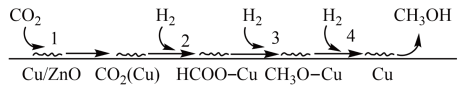
①过程2的化学方程式为_______ 。
②研究表明,过程3的活化能小但实际反应速率慢,是速控步骤,导致该步反应速率小的原因可能是_______ (填标号)。
A.温度变化导致活化能增大 B.温度变化导致平衡常数减小
C. 对该反应有阻碍作用 D.
对该反应有阻碍作用 D. 的存在削弱了同一吸附位上
的存在削弱了同一吸附位上 的吸附
的吸附
(3)一定温度下, 和
和 制备甲醇的主要反应为:
制备甲醇的主要反应为: ,在容积恒定的密闭容器中充入
,在容积恒定的密闭容器中充入 和
和 ,达到平衡时测得容器内的压强为
,达到平衡时测得容器内的压强为 ,
, 的物质的量为
的物质的量为 。在此条件下,
。在此条件下, 的转化率
的转化率
_______ ,该反应的平衡常数
_______ (以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)一种捕集烟气中 的过程如图所示。室温下以
的过程如图所示。室温下以 溶液吸收
溶液吸收 ,若通入
,若通入 所引起的溶液体积变化和
所引起的溶液体积变化和 挥发可忽略,溶液中含碳物种的浓度
挥发可忽略,溶液中含碳物种的浓度 。
。 电离常数分别为
电离常数分别为 、
、 。完成下列问题:
。完成下列问题:
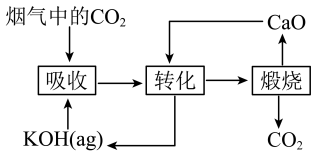
①如图所示的“吸收”“转化”过程中,溶液的温度_______ (填“下降”、“不变”或“上升”)。
②KOH完全转化为 时,溶液中:
时,溶液中:
_______ 。
③KOH溶液吸收 ,
, 溶液中:
溶液中:
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(1)利用
| 化学键 | ||||
| 键能 | 414 | 436 | 745 | 463 |
(2)Fujta等学者开展了在

①过程2的化学方程式为
②研究表明,过程3的活化能小但实际反应速率慢,是速控步骤,导致该步反应速率小的原因可能是
A.温度变化导致活化能增大 B.温度变化导致平衡常数减小
C.
(3)一定温度下,
(4)一种捕集烟气中

①如图所示的“吸收”“转化”过程中,溶液的温度
②KOH完全转化为
③KOH溶液吸收
为减少CO2排放、科学家着眼于能源转换和再利用等问题。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
则反应CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)的∆H=_______ kJ•mol-1。
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是_______ (填编号)。
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为_______ 。
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。
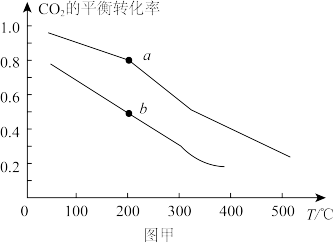
a、b两点正反应速率分别用va、vb表示,则va_______ vb(填“大于”、“小于”或“等于”)。
b点对应的平衡常数Kp=_______ MPa-2(Kp为以平衡分压代替平衡浓度表示的平衡常数。分压=总压×物质的量分数)。
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。
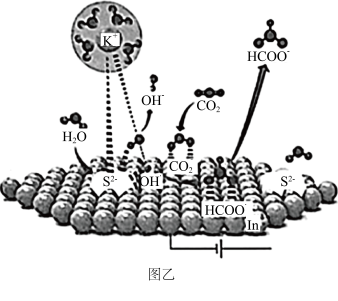
①图乙中,催化剂S2-活性位点在催化过程中的作用是_______ 。
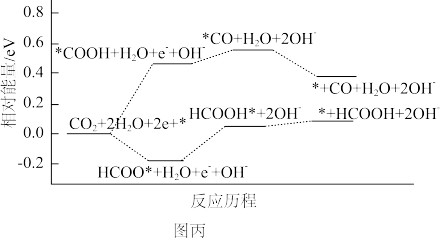
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为_______ ,从反应能垒角度分析该催化剂对生成甲酸具有高选择性的原因:_______ 。
(1)CO2甲烷化反应最早由化学家Paul Sabatier提出。在一定的温度和压力下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。
①已知部分共价键键能如表。
| 化学键 | C=O | C-H | H-H | H-O |
| 键能/kJ•mol-1 | 745.0 | 413.4 | 436.0 | 462.8 |
②向刚性绝热密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是
A.容器内温度不变 B.混合气体平均密度保持不变
C.CH4的体积分数保持不变 D.v正(CO2)=v逆(H2O)
(2)CO2与H2在某催化剂表面制甲醇的化学方程式是:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ∆H<0。
①320℃时,CO2与H2按体积比1:4投入到刚性密闭容器中,同时加入催化剂发生合成甲醇的反应,测得初始时压强为p,反应一段时间后达到平衡,测得CO2的平衡转化率为50%,则平衡时体系的压强为
②若将2molCO2和6molH2充入密闭容器中发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0。图甲表示压强为0.1 MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。

a、b两点正反应速率分别用va、vb表示,则va
b点对应的平衡常数Kp=
(3)我国科学家用S-In催化剂电催化还原CO2制甲酸的机理如图乙所示,其中吸附在催化剂表面的原子用*标注。

①图乙中,催化剂S2-活性位点在催化过程中的作用是
②图丙为催化还原CO2的反应历程图。其中,生成甲酸的决速步骤的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


