填空题 适中0.65 引用1 组卷68
Ι.下列物质属于强电解质且能导电的是___________ ;(请填入符合题意的编号)
①氢氧化钠溶液 ②硫酸铝固体 ③铜 ④葡萄糖 ⑤熔融氯化镁 ⑥稀硫酸 ⑦乙酸。
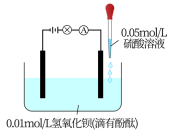
Ⅱ.探究离子反应的实验装置如图。向滴有几滴酚酞的0.01mol·L-1Ba(OH)2溶液中逐滴滴入0.05mol·L-1H2SO4溶液,直至过量。酚酞由红色变为无色时,观察到的实验现象还有___________ 。
Ⅲ.金属单质四兄弟W、X、Y、Z不小心掉到稀盐酸池中,反应如下图所示,则它们的还原性由弱到强的顺序是___________ ;

Ⅳ.以下物质之间的每步反应转化,都能通过一步实现的是___________ ;(请填入符合题意的编号)
a.Na→Na2O→Na2CO3→NaHCO3→NaOH
b.Al→Al2O3→Al(OH)3→NaAlO2
c.Mg→MgCl2→Mg(OH)2→MgSO4
d.Fe→FeCl2→Fe(OH)2→Fe(OH)3
e.Al3+→Al(OH)3→ →Al(OH)3→Al
→Al(OH)3→Al
Ⅴ.关于Na2CO3和NaHCO3,下列比较正确的是___________ 。(请填入符合题意的编号)
①相同温度下,Na2CO3的溶解度比NaHCO3大
②Na2CO3的热稳定性比NaHCO3强
③相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液的pH比NaHCO3溶液的pH大
④等物质的量Na2CO3和NaHCO3分别和盐酸反应,剧烈程度是Na2CO3强于NaHCO3
⑤相同质量的Na2CO3和NaHCO3分别和足量盐酸反应,产生的CO2在相同条件下的体积是Na2CO3大于NaHCO3
①氢氧化钠溶液 ②硫酸铝固体 ③铜 ④葡萄糖 ⑤熔融氯化镁 ⑥稀硫酸 ⑦乙酸。
Ⅱ.探究离子反应的实验装置如图。向滴有几滴酚酞的0.01mol·L-1Ba(OH)2溶液中逐滴滴入0.05mol·L-1H2SO4溶液,直至过量。酚酞由红色变为无色时,观察到的实验现象还有

Ⅲ.金属单质四兄弟W、X、Y、Z不小心掉到稀盐酸池中,反应如下图所示,则它们的还原性由弱到强的顺序是

Ⅳ.以下物质之间的每步反应转化,都能通过一步实现的是
a.Na→Na2O→Na2CO3→NaHCO3→NaOH
b.Al→Al2O3→Al(OH)3→NaAlO2
c.Mg→MgCl2→Mg(OH)2→MgSO4
d.Fe→FeCl2→Fe(OH)2→Fe(OH)3
e.Al3+→Al(OH)3→
Ⅴ.关于Na2CO3和NaHCO3,下列比较正确的是
①相同温度下,Na2CO3的溶解度比NaHCO3大
②Na2CO3的热稳定性比NaHCO3强
③相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液的pH比NaHCO3溶液的pH大
④等物质的量Na2CO3和NaHCO3分别和盐酸反应,剧烈程度是Na2CO3强于NaHCO3
⑤相同质量的Na2CO3和NaHCO3分别和足量盐酸反应,产生的CO2在相同条件下的体积是Na2CO3大于NaHCO3
20-21高一上·江西抚州·阶段练习
类题推荐
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,发生反应3A(g)+B(g) xC(g) ΔH=Q kJ/mol,回答下列问题:
xC(g) ΔH=Q kJ/mol,回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是___________ (填序号)
①化学反应速率:v(A)=3v(B)
②混合气体的密度保持不变
③有3mol A消耗的同时有1mol B生成
④C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q___________ 0(填“大于”或“小于”)
(3)向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g) xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2。
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2。
①若平衡时,甲、乙两容器中A的物质的量相等,则x=___________ ;
②平衡时甲中A的体积分数为___________ ;
③若平衡时两容器的压强不相等,则两容器中压强之比为___________ 。
Ⅱ.请回答下列问题:
(4)pH=3的盐酸aL,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水bL;②物质的量浓度为1×10-3mol/L氨水cL;
③c(OH-)=1×10-3mol/L的Ba(OH)2溶液dL;
试判断a、b、c、d的大小关系正确的是___________
(5)已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,两溶液中c(H+)·c(OH-)=___________ ;各取5mL上述溶液,分别加水稀释至50mL,pH较大的是___________ 溶液;各取5mL上述溶液,分别加热到90℃,pH较小的是___________ 溶液。
(6)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH )由大到小的顺序是:
)由大到小的顺序是:___________ (填编号)。
Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(7)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是___________ ;
(8)下列叙述不正确的是___________ (填字母)
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,发生反应3A(g)+B(g)
(1)下列各项能作为判断该反应达到化学平衡状态的依据是
①化学反应速率:v(A)=3v(B)
②混合气体的密度保持不变
③有3mol A消耗的同时有1mol B生成
④C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q
(3)向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g)
①若平衡时,甲、乙两容器中A的物质的量相等,则x=
②平衡时甲中A的体积分数为
③若平衡时两容器的压强不相等,则两容器中压强之比为
Ⅱ.请回答下列问题:
(4)pH=3的盐酸aL,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水bL;②物质的量浓度为1×10-3mol/L氨水cL;
③c(OH-)=1×10-3mol/L的Ba(OH)2溶液dL;
试判断a、b、c、d的大小关系正确的是___________
| A.a=b>c>d | B.b>a=d>c | C.c>a>d>b | D.c>a=d>b |
(6)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH
Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(7)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是
(8)下列叙述不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
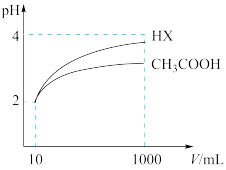
 CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是 

