解答题-原理综合题 适中0.65 引用1 组卷111
Ⅰ. 已知部分弱酸的电离平衡常数如下表,请回答下列问题。
(1)同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是___________ ;
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________ 。
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于熔烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________ 。(用必要的方程式说明);
(2)相同条件下,0.1mol·L-1 NH4Al(SO4)2中
___________ 0.1mol·L-1 NH4HSO4中 。(填“=”、“﹥”或“﹤”)
。(填“=”、“﹥”或“﹤”)
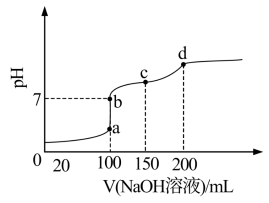
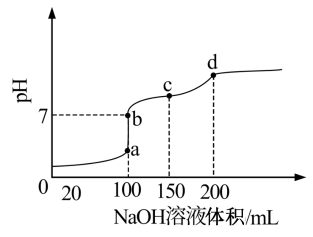
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________ ,在b点,溶液中各离子浓度由大到小的排列顺序___________ 。
| 弱酸 | HCOOH | HCN | H2CO3 | H3BO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 5.8×10-8 |
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于熔烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是
(2)相同条件下,0.1mol·L-1 NH4Al(SO4)2中
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

20-21高二上·天津红桥·阶段练习
类题推荐
Ⅰ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(N )
)___________ (填“等于”“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(N )。
)。
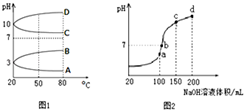
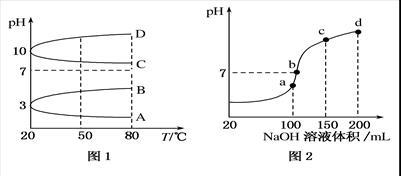
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是___________ (填写字母);
②室温时,0.1 mol·L-1NH4Al(SO4)2中2c(S )-c(N
)-c(N )-3c(Al3+)=
)-3c(Al3+)=________ mol·L-1(填数值)。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是________ ;在b点,溶液中各离子浓度由大到小的排列顺序是___________________________ 。
Ⅱ.已知25 ℃时,有关弱酸的电离平衡常数如下表:
则等物质的量浓度的a. CH3COONa,b. NaCN,c.Na2CO3,d. NaHCO3溶液的pH由大到小的顺序是______________ (填编号),0.18 mol·L-1CH3COONa的pH约为____________

(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(N
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是
②室温时,0.1 mol·L-1NH4Al(SO4)2中2c(S
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
Ⅱ.已知25 ℃时,有关弱酸的电离平衡常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
则等物质的量浓度的a. CH3COONa,b. NaCN,c.Na2CO3,d. NaHCO3溶液的pH由大到小的顺序是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网