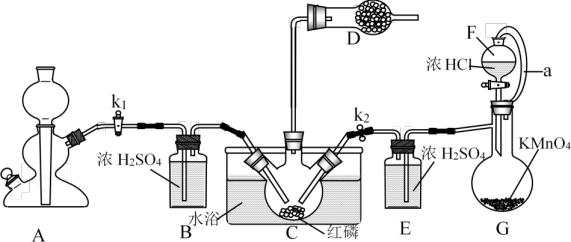
解答题-实验探究题 较难0.4 引用1 组卷234
三氯化磷( PCl3)是合成药物的重要化工原料,可通过白磷和氯气常温下化合得到。已知:白磷与少量Cl2反应生成PCl2与过量Cl2反应生成PCl5 ;PCl3遇O2会生成三氯氧磷(POCl3),
回答下列问题:
I. PCl3的制备:
(1)装置A中发生反应的离子方程式为___________ 。
(2)常温下,装置C中生成PCl3气体,说明白磷和氯气反应生成PCl3是___________ (填“吸热反应”或“放热反应")。
(3)装置E的作用是___________ 。
II.含磷化合物的性质:
(4) POCl3和PCl3遇水会强烈水解,则POC13水解的化学方程式为___________ ;PCl3水解生成亚磷酸(H3PO3)和HCl,H3PO3是一种二元弱酸,其电离平衡常数分别为:Ka1=5×10-2,Ka2=2.5×10-7;则H3PO3与足量的NaOH溶液反应生成的盐是___________ 。(填化学式),NaH2PO3是亚磷酸的一种盐,则NaH2PO3溶液显___________ 性(填“酸”、“碱”或“中”)。
III. PCl3纯度的测定:
实验结束后,装置D中收集的PCl3中含有PCl3和POCl3加入过量白磷加热可将PCl5转化为PCl3,再通过蒸馏,收集70.0℃~80.0℃的馏分,可得到PC13产品。
①取a g。上述所得的PC13产品,置于盛有50.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液;
②取10.00mlL上述溶液于锥形瓶中,先用稀硝酸酸化,再加入V1mLc1 mol·L-1AgNO3溶液(过量) ,使Cl-完全转化为AgCl沉淀;
③加入少量硝基苯(硝基苯密度比水大,且难溶于水);。
④以硫酸铁溶液为指示剂,用c2 mol·L-1KSCN溶液滴定过量的AgNO3溶液( AgSCN难溶于水),达到滴定终点时,共用去V2 mL KSCN溶液。
(5)滴定终点的现象为___________ 。
(6)若测定过程中没有加入硝基苯。则所测PCl3的含量将会___________ (填“ 偏大”、“偏小”或“不变")。
(7)上述产品中PCl3的质量分数为___________ 。
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 遇水均剧烈水解 |
| PCl5 | 148 | 200℃分解 | 208.5 | |
| POCl3 | 2.0 | 106.0 | 153. 5 |
I. PCl3的制备:

(1)装置A中发生反应的离子方程式为
(2)常温下,装置C中生成PCl3气体,说明白磷和氯气反应生成PCl3是
(3)装置E的作用是
II.含磷化合物的性质:
(4) POCl3和PCl3遇水会强烈水解,则POC13水解的化学方程式为
III. PCl3纯度的测定:
实验结束后,装置D中收集的PCl3中含有PCl3和POCl3加入过量白磷加热可将PCl5转化为PCl3,再通过蒸馏,收集70.0℃~80.0℃的馏分,可得到PC13产品。
①取a g。上述所得的PC13产品,置于盛有50.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液;
②取10.00mlL上述溶液于锥形瓶中,先用稀硝酸酸化,再加入V1mLc1 mol·L-1AgNO3溶液(过量) ,使Cl-完全转化为AgCl沉淀;
③加入少量硝基苯(硝基苯密度比水大,且难溶于水);。
④以硫酸铁溶液为指示剂,用c2 mol·L-1KSCN溶液滴定过量的AgNO3溶液( AgSCN难溶于水),达到滴定终点时,共用去V2 mL KSCN溶液。
(5)滴定终点的现象为
(6)若测定过程中没有加入硝基苯。则所测PCl3的含量将会
(7)上述产品中PCl3的质量分数为
21-22高三上·安徽池州·期末
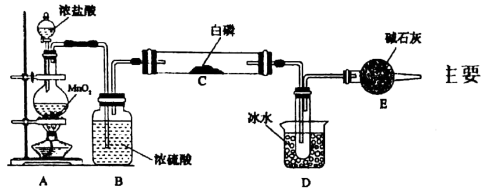
类题推荐  是重要的化工原料,实验室利用红磷制取粗
是重要的化工原料,实验室利用红磷制取粗 的装置如图,夹持装置略去,已知红磷与少量
的装置如图,夹持装置略去,已知红磷与少量 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成 ,
, 遇水会强烈水解生成
遇水会强烈水解生成 ,遇
,遇 会生成
会生成 。
。 、
、 的熔沸点见下表。
的熔沸点见下表。
回答下列问题:
(1)A、C中所盛试剂为___________ ,装置中a的作用是___________ 。
(2)实验时,检查装置气密性后,先打开 通入
通入 ,再迅速加入红磷,通入
,再迅速加入红磷,通入 的作用是
的作用是___________ 。
(3)装置B中的反应需要65~70℃,较适合的加热方式为___________ ,装置E中盛有碱石灰,其作用为___________ 。
(4)实验结束后,装置B中制得的 粗产品中常混有
粗产品中常混有 、
、 等。加入过量红磷加热可将
等。加入过量红磷加热可将 转化为
转化为 ,通过
,通过___________ (填操作名称),即可得到较纯净的 产品。
产品。
(5) 纯度测定
纯度测定
步骤I:取ag上述所得 产品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成250mL溶液;
产品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成250mL溶液;
步骤Ⅱ:取25.00mL上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入 mL
mL 溶液(过量),使
溶液(过量),使 完全转化为AgCl沉淀(
完全转化为AgCl沉淀( 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用 KSCN溶液滴定过量的
KSCN溶液滴定过量的 溶液(
溶液( 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去 mLKSCN溶液。
mLKSCN溶液。
步骤I中发生反应的化学方程式为___________ ,产品中 的质量分数为
的质量分数为___________ %,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
| 物质 | 熔点/℃ | 沸点/℃ |
| 75.5 | ||
| 1.3 | 105.3 |
(1)A、C中所盛试剂为
(2)实验时,检查装置气密性后,先打开
(3)装置B中的反应需要65~70℃,较适合的加热方式为
(4)实验结束后,装置B中制得的
(5)
步骤I:取ag上述所得
步骤Ⅱ:取25.00mL上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
步骤Ⅲ:加入少硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
步骤I中发生反应的化学方程式为
三氯化磷(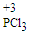 )和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
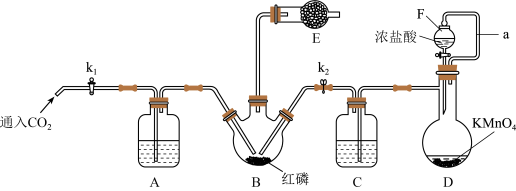
I.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3。实验室制取PCl3的装置示意图和有关数据如下:
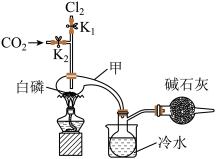
实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作顺序是:打开K2,使体系中充满CO2,再加入白磷,打开K1,通入氯气,再加热。
(1)干燥管中碱石灰的作用是_______________ 。
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是____________________ (已知亚磷酸H3PO3是二元弱酸:H3PO3 H++ H2PO
H++ H2PO ,H2PO3-
,H2PO3- H++HPO
H++HPO )。
)。
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用____________方法除去PC13中的POCl3制备纯净的PCl3。
II.氯化水解法生产POC13
主要反应是:PC13+C12+H2O=POC13+2HCl,流程如下:
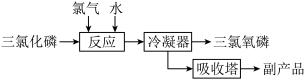
(4)若将0.01mol POCl3加到水中水解,再与含2.4gNaOH的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是_____________ [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
(5)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量NaOH 溶液,再加稀硝酸至酸性。
B.向锥形瓶中加入0.1000 mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_____________ (填字母序号),滴定终点的现象为__________________
A.FeCl2B.NH4Fe(SO4)2C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,所测Cl元素含量将会______________ (填“偏大”、“偏小”或“不变”)。
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为______________ 。
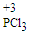 )和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。I.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3。实验室制取PCl3的装置示意图和有关数据如下:

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)干燥管中碱石灰的作用是
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用____________方法除去PC13中的POCl3制备纯净的PCl3。
| A.萃取 | B.过滤 | C.蒸馏 | D.蒸发结晶 |
II.氯化水解法生产POC13
主要反应是:PC13+C12+H2O=POC13+2HCl,流程如下:

(4)若将0.01mol POCl3加到水中水解,再与含2.4gNaOH的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是
(5)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量NaOH 溶液,再加稀硝酸至酸性。
B.向锥形瓶中加入0.1000 mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是
A.FeCl2B.NH4Fe(SO4)2C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,所测Cl元素含量将会
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网