解答题-原理综合题 适中0.65 引用1 组卷150
消除氮氧化物的污染对建设生态文明具有重要的意义。回答下列问题:
(1)用活性炭还原法可以处理氮氧化物,发生反应为C(s)+2NO(g)⇌N2(g)+CO2(g)。
①已知:C(s)和CO(g)的燃烧热分别为393.5 kJ·mol-1和283 kJ·mol-1;CO(g)和NO(g)反应的热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-747.8kJ·mol-1.则用活性炭还原法反应的ΔH=________ kJ·mol-1,欲提高NO平衡转化率,可采取的措施有_________ 。
②实验室模拟活性炭还原氮氧化物的过程:向2L固定体积的密度容器中,加入足量的活性炭,再充入1molNO,在一定温度下反应,50min时达到平衡,测得混合气体中CO2的物质的量为0.2mol,则平衡时NO的转化率为_________ ,该反应的平衡常数Kp=_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)Cl2也可以与NO反应:2NOCl(g)⇌2NO(g)+C12(g)。一定温度下,用NOCl和Cl2表示该反应的反应速率分别为υ正=k正·c2(NOCl),v逆=k逆·c 2(NO)·c(Cl2)(k1、k2为速率常数)。向2 L密闭容器中充入a mol NOCl(g),测得NO的物质的量浓度与温度的关系如图所示(x<0.5a)。T1_______ T2(填“>”、“<”或“=”);T2温度下, =
=_______ (用含a、x的代数式表示)。
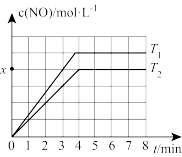
(1)用活性炭还原法可以处理氮氧化物,发生反应为C(s)+2NO(g)⇌N2(g)+CO2(g)。
①已知:C(s)和CO(g)的燃烧热分别为393.5 kJ·mol-1和283 kJ·mol-1;CO(g)和NO(g)反应的热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-747.8kJ·mol-1.则用活性炭还原法反应的ΔH=
②实验室模拟活性炭还原氮氧化物的过程:向2L固定体积的密度容器中,加入足量的活性炭,再充入1molNO,在一定温度下反应,50min时达到平衡,测得混合气体中CO2的物质的量为0.2mol,则平衡时NO的转化率为
(2)Cl2也可以与NO反应:2NOCl(g)⇌2NO(g)+C12(g)。一定温度下,用NOCl和Cl2表示该反应的反应速率分别为υ正=k正·c2(NOCl),v逆=k逆·c 2(NO)·c(Cl2)(k1、k2为速率常数)。向2 L密闭容器中充入a mol NOCl(g),测得NO的物质的量浓度与温度的关系如图所示(x<0.5a)。T1
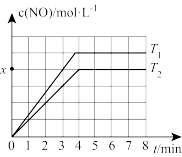
20-21高三下·山东济南·阶段练习
类题推荐
NO是大气中一种重要污染物,可以采用多种方法消除NO的污染。回答下列问题:
(1)CH4还原NO法
已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-116.2 kJ·mol-1;
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1;
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-863.8 kJ·mol-1。
则CH4与NO反应生成N2、CO2和H2O(g)的热化学方程式为_______ 。
(2)CO还原NO法。CO还原NO的反应为2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H<0。
①该反应中,既要加快NO的消除速率,又要消除更多的NO,可采取措施有_______ (写出其中一条即可)。
②实验测得:v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。达到平衡后,只升高温度,k正增大的倍数_______ (填“>”、“<”或“=”) k逆增大的倍数。若在1 L恒容密闭容器中充入1 mol CO和1 mol NO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则 =
=_______ (计算结果用分数表示)。
(3)NH3还原NO法。NH3还原NO的反应为4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) △H<0。T℃时,在恒容密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
若反应开始时的压强为P0,则该反应的化学平衡常数Kp=_______ (可用分数表示;用平衡分压代替平衡浓度计算,各气体的分压=气体总压×各气体的物质的量分数)。
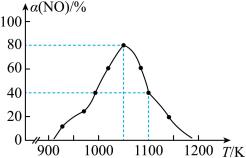
(4)SCR脱硝技术的主反应为4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) △H<0。在密闭容器中起始投入一定量NH3、NO、O2进行反应,测得不同温度下,在相同时间内部分组分的含量如图所示。

①a、b、c三点,主反应速率由大到小的顺序为_______ 。
②解释N2的浓度变化曲线先上升后下降的原因:_______ 。
(1)CH4还原NO法
已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-116.2 kJ·mol-1;
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1;
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-863.8 kJ·mol-1。
则CH4与NO反应生成N2、CO2和H2O(g)的热化学方程式为
(2)CO还原NO法。CO还原NO的反应为2CO(g)+2NO(g)⇌2CO2(g)+N2(g) △H<0。
①该反应中,既要加快NO的消除速率,又要消除更多的NO,可采取措施有
②实验测得:v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。达到平衡后,只升高温度,k正增大的倍数
(3)NH3还原NO法。NH3还原NO的反应为4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) △H<0。T℃时,在恒容密闭容器中,测得在不同时间NO和NH3的物质的量如下表:
| 时间/min | 0 | 1 | 2 | 3 | 4 |
| n(NO)/mol | 1.2 | 0.90 | 0.72 | 0.60 | 0.60 |
| n(NH3)/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
(4)SCR脱硝技术的主反应为4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) △H<0。在密闭容器中起始投入一定量NH3、NO、O2进行反应,测得不同温度下,在相同时间内部分组分的含量如图所示。

①a、b、c三点,主反应速率由大到小的顺序为
②解释N2的浓度变化曲线先上升后下降的原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网