解答题-原理综合题 适中0.65 引用1 组卷31
氮及其化合物在生产、生活中有着重要的作用。请回答下列问题:
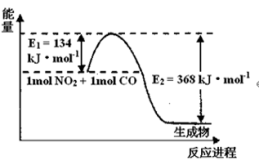
(1)下图是常温下1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______
(2)在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)⇌2NO2(g) △H 如图
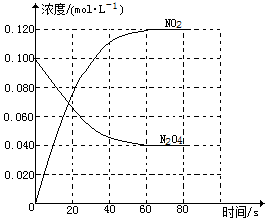
①在0-60s时段,反应速率v (N2O4)为_______ mol·L-1·s-1。
②温度升高,混合气体的颜色变深,则△H_______ 0 (填“>”或“<”)。
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有_______ (填字母)。
A.向混合气体中通入N2O4 B.升高温度
C.向混合气体中通入NO2 D.使用高效催化剂
(3)实验室可用NaOH溶液吸收NO2 ,反应2NO2 +2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2 恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液。
①A、B两溶液中c( )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为_______ (已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1)。
②可使A、B两溶液的PH相等的方法是_______ (填字母)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(1)下图是常温下1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

(2)在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)⇌2NO2(g) △H 如图

①在0-60s时段,反应速率v (N2O4)为
②温度升高,混合气体的颜色变深,则△H
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有
A.向混合气体中通入N2O4 B.升高温度
C.向混合气体中通入NO2 D.使用高效催化剂
(3)实验室可用NaOH溶液吸收NO2 ,反应2NO2 +2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2 恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液。
①A、B两溶液中c(
②可使A、B两溶液的PH相等的方法是
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
20-21高三上·云南保山·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 NaNO3(s)+ClNO(g)K1Q > 0(I)
NaNO3(s)+ClNO(g)K1Q > 0(I) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)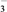 )、c(NO
)、c(NO )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为

