解答题-实验探究题 适中0.65 引用3 组卷222
实验室模拟“侯氏制碱法”原理,以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3; NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
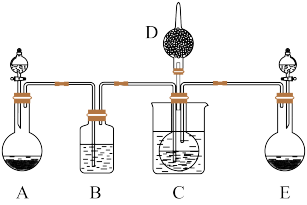
(1)利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉。图中夹持装置已略去。
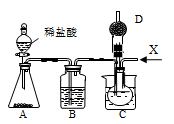
①实验室制备X气体的化学方程式为___________ 。
②B中应盛有___________ 溶液。在实验过程中,应向C中先通入足量的___________ 。
(2)该小组同学为了测定C中所得碳酸氢钠晶体的纯度,称取1.50g样品,将其配成100mL溶液。移取20.00mL溶液于锥形瓶中,用0.2000mol·L−1 的盐酸进行滴定。溶液pH随盐酸溶液加入量变化的曲线如下图所示。
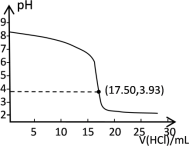
①根据曲线判断能够准确指示滴定终点现象的指示剂为___________ 。
②碳酸氢钠的纯度为___________ 。
(1)利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉。图中夹持装置已略去。

①实验室制备X气体的化学方程式为
②B中应盛有
(2)该小组同学为了测定C中所得碳酸氢钠晶体的纯度,称取1.50g样品,将其配成100mL溶液。移取20.00mL溶液于锥形瓶中,用0.2000mol·L−1 的盐酸进行滴定。溶液pH随盐酸溶液加入量变化的曲线如下图所示。
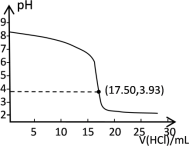
①根据曲线判断能够准确指示滴定终点现象的指示剂为
②碳酸氢钠的纯度为
20-21高三上·江西赣州·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网