填空题 适中0.65 引用1 组卷176
CO、CH4 和 N2H4都可以作为燃料。回答下列问题:
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H= +206.4 kJ·mol-1。该反应能自发进行的条件为:______ 。(选填“任何条件”、“低温”、“高温”、“任何条件均不能自发”)
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是______ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是______ 。
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8 g气体肼在上述反应中放出142 kJ热量,其热化学方程式为______ 。
(5)草酸与KMnO4在酸性条件下能够发生如下反应:MnO +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
如果研究催化剂对化学反应速率的影响,应选用实验______ 和______ (用Ⅰ~Ⅳ表示)。
(1)工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H= +206.4 kJ·mol-1。该反应能自发进行的条件为:
(2)对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)恒温恒容条件下,以下能说明该反应达到平衡状态的是
a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8 g气体肼在上述反应中放出142 kJ热量,其热化学方程式为
(5)草酸与KMnO4在酸性条件下能够发生如下反应:MnO
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | / |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | / |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
如果研究催化剂对化学反应速率的影响,应选用实验
19-20高二下·浙江宁波·期末
类题推荐
回答下列问题:
(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种气体混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为___ 。
(2)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11kJ·mol-1,1 molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___ kJ。
(3)草酸与KMnO4在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
①如果研究催化剂对化学反应速率的影响,使用实验___ 和____ (用Ⅰ~Ⅳ表示,下同)。
②如果研究温度对化学反应速率的影响,使用实验____ 和____ 。
③对比实验Ⅰ和Ⅳ,可以研究____ 对化学反应速率的影响。
(1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种气体混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为
(2)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11kJ·mol-1,1 molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(3)草酸与KMnO4在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | / |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | / |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
②如果研究温度对化学反应速率的影响,使用实验
③对比实验Ⅰ和Ⅳ,可以研究
I.草酸与高锰酸钾在酸性条件下能够发生如下反应:Mn +H2C2O4+H+→Mn2++CO2↑+H2O(未配平),用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平),用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
(1)该反应中氧化剂和还原剂的物质的量之比为_______ 。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______ 和_______ (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验_______ 和_______ 。
(3)对比实验Ⅰ和Ⅳ,可以研究_______ 对化学反应速率的影响,实验Ⅳ加入1 mL蒸馏水的目的是_______ 。
II.某可逆反应在容积为5 L的密闭容器中进行,在从0~3 min内各物质的量的变化情况如图所示(A、B、C均为气体)。
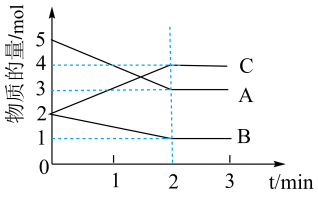
(4)该反应的化学方程式为_______ 。
(5)反应开始至2分钟时,B的平均反应速率为_______ 。
(6)在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是_______ (填序号)。
①降低温度 ②加入催化剂 ③增大容器体积
| 实验编号 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | — |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | — |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(2)如果研究催化剂对化学反应速率的影响,使用实验
(3)对比实验Ⅰ和Ⅳ,可以研究
II.某可逆反应在容积为5 L的密闭容器中进行,在从0~3 min内各物质的量的变化情况如图所示(A、B、C均为气体)。

(4)该反应的化学方程式为
(5)反应开始至2分钟时,B的平均反应速率为
(6)在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会减小的是
①降低温度 ②加入催化剂 ③增大容器体积
研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)=Fe3 O4(s)+H2(g) △H=+18. 7 kJ·mol-1
则反应6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)的△H=__________________ 。
(2)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+ N2O4(g)=3N2(g)+4H2O(g) △H=-a kJ·mol-1。
已知反应中相关的化学键键能数据如下:
则完全断裂1molN2O4(g)分子中的化学键需要吸收的能量是__________ kJ。
(3)在体积均为1.0L的两个恒容密闭容器中加入足量相同的碳粉,再分别通入0.1molCO2和0.2 mol CO2,在不同温度下发生反应CO2(g)+C(s) 2CO(g),平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
2CO(g),平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
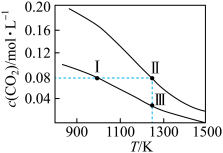
①该反应△H__________ 0(填“>”或“<”),在__________ (填“高温”“低温”或“任意温度”)下可自发进行。
②该反应的平衡常数:K(Ⅱ)__________ K(Ⅲ),反应速率:v正(I) __________ v逆 (Ⅲ)。(填“>”“<”或“=”)
③恒温恒容条件下,下列说法中能说明该反应达到化学平衡状态的是_________ (填标号)。
a.混合气体的密度不变
b.混合气体的平均相对分子质量不变
C.v逆(CO2)=2v正(CO)
d.单位时间内,生成2 n mol CO2的同时生成 m mol CO
④在平衡状态I时,平衡常数为__________ mol·L-1,体系中CO2和CO的分压之比为__________ (气体分压=气体总压×体积分数)。
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)=Fe3 O4(s)+H2(g) △H=+18. 7 kJ·mol-1
则反应6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)的△H=
(2)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+ N2O4(g)=3N2(g)+4H2O(g) △H=-a kJ·mol-1。
已知反应中相关的化学键键能数据如下:
| 化学键 | ||||
| 键能/kJ·mol-1 | b | c | d | e |
则完全断裂1molN2O4(g)分子中的化学键需要吸收的能量是
(3)在体积均为1.0L的两个恒容密闭容器中加入足量相同的碳粉,再分别通入0.1molCO2和0.2 mol CO2,在不同温度下发生反应CO2(g)+C(s)

①该反应△H
②该反应的平衡常数:K(Ⅱ)
③恒温恒容条件下,下列说法中能说明该反应达到化学平衡状态的是
a.混合气体的密度不变
b.混合气体的平均相对分子质量不变
C.v逆(CO2)=2v正(CO)
d.单位时间内,生成2 n mol CO2的同时生成 m mol CO
④在平衡状态I时,平衡常数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


