填空题 适中0.65 引用1 组卷180
Ⅰ.已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)_______ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_______ (填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为_______ (填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______ 。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为_______ 。
Ⅱ.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
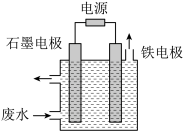
含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为_______ (填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______ ,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为_______ 。
| 醋酸 | 氢硫酸 | 氢氰酸 |
| Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为
Ⅱ.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为

20-21高二上·湖北荆州·期末
类题推荐
已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)体积相同、 相同的三种酸溶液a.
相同的三种酸溶液a. ;b.HCN;c.
;b.HCN;c. 分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是
分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是___________ 。(填字母)
(2)25℃时,等浓度的三种溶液①NaCN溶液、② 溶液、③
溶液、③ 溶液,pH由大到小的顺序为
溶液,pH由大到小的顺序为___________ (填序号)。
(3)25℃时,浓度均为0.01 mol/L的①NaCN、② 、③NaCl溶液中,阴离子总浓度由大到小的顺序为
、③NaCl溶液中,阴离子总浓度由大到小的顺序为___________ (填序号)。
(4)将浓度为0.02 mol/L的HCN与0.01 mol/L NaOH溶液等体积混合,测得混合溶液中 ,下列关系正确的是
,下列关系正确的是___________ 。
a.
b.
c. mol/L
mol/L
(5)25℃时,向NaCN溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(6)下列四种离子结合质子能力由大到小的顺序是___________ (填字母)。
a. b.
b. c.
c. d.
d.
(7)用蒸馏水稀释0.10 mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是___________ (填字母)。
a. b.
b. c.
c.
| 醋酸 | 氢硫酸 | 氢氰酸 |
(2)25℃时,等浓度的三种溶液①NaCN溶液、②
(3)25℃时,浓度均为0.01 mol/L的①NaCN、②
(4)将浓度为0.02 mol/L的HCN与0.01 mol/L NaOH溶液等体积混合,测得混合溶液中
a.
b.
c.
(5)25℃时,向NaCN溶液中通入少量
(6)下列四种离子结合质子能力由大到小的顺序是
a.
(7)用蒸馏水稀释0.10 mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是
a.
已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________ (填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为_____________ (填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______ 。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________ 。
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为
已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)写出碳酸的第一步电离方程式___________ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_______ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___________ 。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______ 。
a.c(H+)-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为_______ (填序号)。
(6)NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康,可用以下方法测定处理后的废水中NaCN的含量。已知:
①废水中NaCN 的最高排放标准为0.50mg/L;
②Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。
实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用______ (填仪器名称)盛装;滴定终点时的现象是_________ 。
②处理后的含NaCN 的废水是否达到排放标准_____ (填“是”或“否”)。
| 醋酸 | 碳酸 | 氢氰酸 |
| Ka=1.7×10-5 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)写出碳酸的第一步电离方程式
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是
a.c(H+)-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为
(6)NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康,可用以下方法测定处理后的废水中NaCN的含量。已知:
①废水中NaCN 的最高排放标准为0.50mg/L;
②Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。
实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用
②处理后的含NaCN 的废水是否达到排放标准
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


