解答题-实验探究题 适中0.65 引用1 组卷86
常温下,某探究小组进行实验时,小组成员用浓度为0.1050mol/L的稀盐酸滴定未知浓度的氨水,用甲基橙作指示剂。回答下列问题:
(1)用仪器甲量取20.00mL待测液,转移到仪器乙中,则仪器甲和仪器乙的名称分别是_______ (填字母),其中需要用待测液润洗的仪器是_______ (填名称)。
a.量筒、酸式滴定管 b.碱式滴定管、烧杯
c.酸式滴定管、锥形瓶 d.碱式滴定管、锥形瓶
(2)达到滴定终点时,滴定管中稀盐酸的液面如下图所示,其读数为_______ mL,若滴定前,滴定管中液体的读数是1.50mL,则该氨水的浓度为_______ mol/L。

(3)下列操作能使测得的待测液浓度偏高的是_______ (填字母)。
a.酸式滴定管未用标准盐酸润洗
b.碱式滴定管用标准液润洗
c.移取待测液的过程中,开始时俯视滴定管液面读数,最后仰视液面读数
d.滴定前滴定管尖嘴中有气泡,滴定终点时气泡消失
e.滴定时标准液溅出
(4)滴定终点的现象是_______ 。
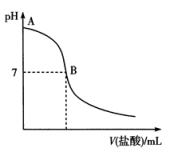
(5)滴定过程中所得溶液的pH变化曲线如图所示,B点时,溶液中离子浓度的大小顺序是_______ 。
(6)氧化还原滴定:用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,你认为合理的是_______ (填字母序号)。
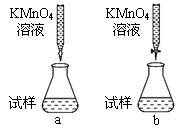
②判断滴定终点的依据是_______ 。
(1)用仪器甲量取20.00mL待测液,转移到仪器乙中,则仪器甲和仪器乙的名称分别是
a.量筒、酸式滴定管 b.碱式滴定管、烧杯
c.酸式滴定管、锥形瓶 d.碱式滴定管、锥形瓶
(2)达到滴定终点时,滴定管中稀盐酸的液面如下图所示,其读数为

(3)下列操作能使测得的待测液浓度偏高的是
a.酸式滴定管未用标准盐酸润洗
b.碱式滴定管用标准液润洗
c.移取待测液的过程中,开始时俯视滴定管液面读数,最后仰视液面读数
d.滴定前滴定管尖嘴中有气泡,滴定终点时气泡消失
e.滴定时标准液溅出
(4)滴定终点的现象是
(5)滴定过程中所得溶液的pH变化曲线如图所示,B点时,溶液中离子浓度的大小顺序是

(6)氧化还原滴定:用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,你认为合理的是

②判断滴定终点的依据是
20-21高二上·陕西延安·期末
类题推荐
现有常温条件下甲、乙、丙三种溶液,甲为0.1mol•L-1的NaOH溶液,乙为0.1mol•L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=____________ 。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为____________ (用甲、乙、丙表示)。
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知: )。
)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需____________ 、_____________ 填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是____________ 。
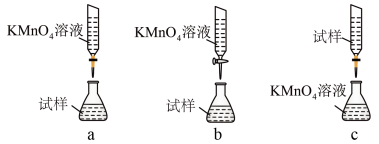
③某同学设计的下列滴定方式中,最合理的是____________ (夹持部分略去,填字母序号),达到滴定终点的现象是____________ 。
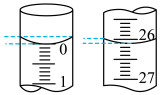
④若滴定开始和结束时,滴定管中的液面如图所示,则终点读数为____________ mL。
⑤某学生根据3次实验分别记录有关数据如下表:
依据上表数据,计算该FeCl2溶液的物质的量浓度为____________ (请保留小数点后两位)。
⑥下列操作中可能使测定结果偏低的是____________ (填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放FeCl2溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(1)甲溶液的pH=
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是
③某同学设计的下列滴定方式中,最合理的是

④若滴定开始和结束时,滴定管中的液面如图所示,则终点读数为

⑤某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测FeCl2溶液的体积/mL | 0.1000mol/LKMnO4的体积(mL) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
依据上表数据,计算该FeCl2溶液的物质的量浓度为
⑥下列操作中可能使测定结果偏低的是
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放FeCl2溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
滴定实验是化学学科中重要的定量实验。
I.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴甲基橙指示剂;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
(1)该酸碱中和滴定(题干中②③④步)所需仪器有___________ (填字母)。
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(10mL)
D.铁架台 E.滴定管夹 F.玻璃棒
(2)排去碱式滴定管中气泡的方法应采用操作___________ 。
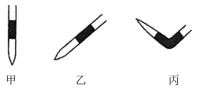
(3)滴定达到终点的现象是___________ 。
(4)试样中NaOH的质量分数为___________ 。
(5)若出现下列情况,测定结果伸高的是___________ 。
a.滴定前用蒸馏水冲洗锥形瓶
b.酸式滴定管滴至终点时,俯视读数
c.酸式滴定管用蒸馏水洗后,未用标准液润洗
d.酸式滴定管尖嘴部分有气泡,滴定后消失
Ⅱ.氧化还原滴定——取草酸( ,弱酸)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1
,弱酸)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 的高锰酸钾溶液滴定。
的高锰酸钾溶液滴定。
(6)发生反应的离子方程式为___________ 。
(7)滴定时, 溶液应装在
溶液应装在___________ 滴定管中(填“酸式”或“碱式”)。
I.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴甲基橙指示剂;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测体积(mL) | 消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(1)该酸碱中和滴定(题干中②③④步)所需仪器有
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(10mL)
D.铁架台 E.滴定管夹 F.玻璃棒
(2)排去碱式滴定管中气泡的方法应采用操作

(3)滴定达到终点的现象是
(4)试样中NaOH的质量分数为
(5)若出现下列情况,测定结果伸高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.酸式滴定管滴至终点时,俯视读数
c.酸式滴定管用蒸馏水洗后,未用标准液润洗
d.酸式滴定管尖嘴部分有气泡,滴定后消失
Ⅱ.氧化还原滴定——取草酸(
(6)发生反应的离子方程式为
(7)滴定时,
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
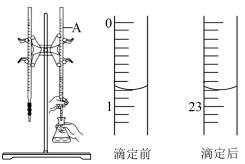
(1)仪器A的名称是___________ ;
(2)盐酸的体积读数:滴定后读数为___________ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是___________  (保留四位有效数字);
(保留四位有效数字);
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
最佳的操作步骤的顺序是___________ 、___________ C___________ A___________ 。(用字母序号填写);
(5)判断到达滴定终点的实验现象是___________ 。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①装标准液的滴定管,滴定前管尖端有气泡,滴定后气泡消失,对测定结果的影响___________ ;
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________ 。

(1)仪器A的名称是
(2)盐酸的体积读数:滴定后读数为
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是
| 实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的体积读数(mL) | 滴定后盐酸的体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
最佳的操作步骤的顺序是
(5)判断到达滴定终点的实验现象是
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①装标准液的滴定管,滴定前管尖端有气泡,滴定后气泡消失,对测定结果的影响
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


