解答题-原理综合题 较易0.85 引用1 组卷111
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(1)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=___________ (用K1、K2表示);
(2)根据反应③判断熵变△S___________ 0(填“>”“=”或“<”),依据反应自发进行的判据:△G=△H-T△S<0时可自发进行,判断:在___________ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃下,测得反应③在某时刻时,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.15 mol·L-1、0.2 mol·L-1、0.4 mol·L-1、0.25 mol·L-1,则此时v正___________ v逆(填“>”“=”或“<”)。
(4)要提高反应③的反应速率,同时增大CH3OH(g)的产率,可采取的措施有___________ (填字母代号)。
A.扩大反应容器的容积 B.使用合适的催化剂
C.缩小反应容器的容积 D.从平衡体系中及时分离出CH3OH(g)
| 化学反应 | 平衡常数 | 平衡常数 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+ H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H3 | K3 |
请回答下列问题:
(1)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(2)根据反应③判断熵变△S
(3)500℃下,测得反应③在某时刻时,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.15 mol·L-1、0.2 mol·L-1、0.4 mol·L-1、0.25 mol·L-1,则此时v正
(4)要提高反应③的反应速率,同时增大CH3OH(g)的产率,可采取的措施有
A.扩大反应容器的容积 B.使用合适的催化剂
C.缩小反应容器的容积 D.从平衡体系中及时分离出CH3OH(g)
20-21高二上·湖北·期中
类题推荐
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
(1)反应②是____ (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____ (用K1、K2表示);根据反应③判断ΔS___ 0(填“>”、“=”或“<”),在____ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___ v(逆)(填“>”、“=”或“<”)。
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A.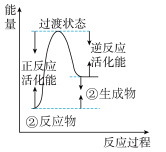 B.
B.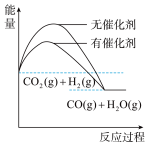 C.
C.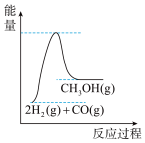 D.
D.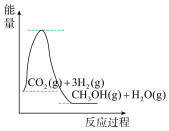
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)
(4)根据上述表格测得焓变,下列能量关系图合理的是
A.
 B.
B. C.
C. D.
D.
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三个化学反应进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(1)反应①是__ (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则:K3=__ (用K1、K2表示),△H3__ △H1+△H2(填“大于”“小于”“等于”)。
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有__ (填字母序号)。
(4)500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正__ v逆(填“大于”“小于”“等于”)
(5)300℃时在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应生成CH3OH变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是__
| 化学反应 | 反应热 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应①是
(2)据反应①与②可推导出K1、K2与K3之间的关系,则:K3=
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有
| A.缩小反应容器的容积 | B.扩大反应容器的容积 |
| C.降低温度 | D.使用合适的催化剂 |
(5)300℃时在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应生成CH3OH变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应体系的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是
| A.2c1>c3 | B.a+b<90.8 | C.2p2<p3 | D.α1+α3<1 |
某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数如下表所示。请回答下列问题:
(1)根据上述反应可推导出 、
、 与
与 之间的关系:
之间的关系:
_______ ;
(2)根据反应③判断熵变
_______ 0(填“>”“=”或“<”),依据反应自发进行的判据:ΔG=ΔH-TΔS<0时反应可自发进行,判断:在_______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃下,测得反应③在某时刻时, 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时v正
,则此时v正____ v逆(填“>”“=”或“<”)。
(4)提高反应③的反应速率且增大 的产率,可采取的措施_______。
的产率,可采取的措施_______。
(5) 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图1所示。反应④完成之后,以
排放并实现资源利用,原理如图1所示。反应④完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
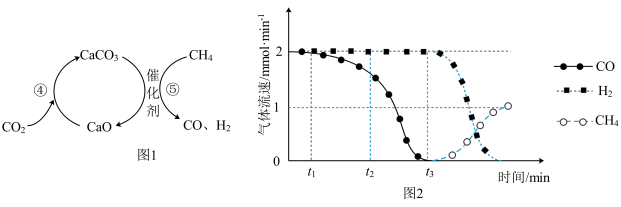
则反应⑤的化学方程式为_______ ,下列叙述正确的是_______ 。
A. ,
, 比
比 多,且生成
多,且生成 速率不变,有可能是发生副反应
速率不变,有可能是发生副反应
B. 时刻,副反应生成
时刻,副反应生成 的速率大于反应⑤生成
的速率大于反应⑤生成 速率
速率
C. 之后,生成
之后,生成 的速率为0,是因为反应⑤不再发生
的速率为0,是因为反应⑤不再发生
| 化学反应 | 平衡常数 | |||
| 500℃ | 700℃ | 800℃ | ||
| ① | 2.5 | 0.34 | 0.15 | |
| ② | 1.0 | 1.70 | 2.52 | |
| ③ | ||||
(2)根据反应③判断熵变
(3)500℃下,测得反应③在某时刻时,
(4)提高反应③的反应速率且增大
| A.扩大反应容器的容积 | B.使用合适的催化剂 |
| C.缩小反应容器的容积 | D.从平衡体系中及时分离出 |

则反应⑤的化学方程式为
A.
B.
C.
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


