解答题-原理综合题 0.65 引用1 组卷118
过硫酸( )是一种强酸,无色晶体,具有极强的氧化性,易溶于水,在热水中易水解。过硫酸盐也具有强氧化性。
)是一种强酸,无色晶体,具有极强的氧化性,易溶于水,在热水中易水解。过硫酸盐也具有强氧化性。
(1)工业上电解 溶液制备
溶液制备 。电解时,阴极(铅电极),阳极(铂电极)。阳极上电极反应为
。电解时,阴极(铅电极),阳极(铂电极)。阳极上电极反应为 。则
。则 中硫元素的化合价为
中硫元素的化合价为_____ ,所含化学键的类型为_____ ,阴极电极反应式为______ 。
(2)已知:过氧化氢不稳定,受热容易分解。工业上利用过硫酸铵制备过氧化氢的一种方法如图。
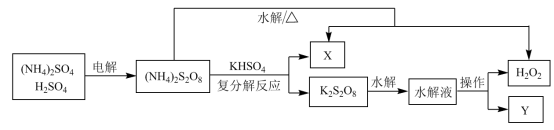
①过氧化氢的电子式为_____ 。
②写出 跟
跟 复分解反应的化学方程式
复分解反应的化学方程式______ ;Y的化学式为_____ 。
③在上流程图中,“操作”的名称为_______ (填“常压蒸馏”或“减压蒸馏”)。这样操作的目的是_____ 。
(3)氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理。
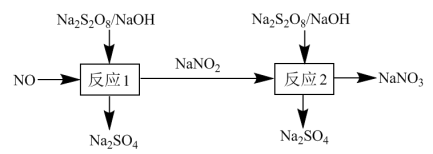
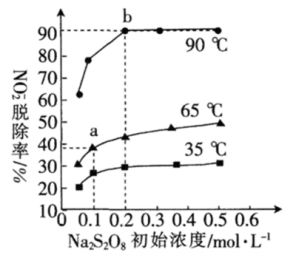
已知“反应2”为 。不同温度下,
。不同温度下, 的初始浓度相同,达到平衡时
的初始浓度相同,达到平衡时 的脱除率与过硫酸钠(
的脱除率与过硫酸钠( )初始浓度的关系如图所示。
)初始浓度的关系如图所示。
①“反应1”的离子方程式为_______ 。
②图中a、b点的反应速率:v(a正)_______ v(b逆)(填“>”“<”或“=”)。
③平衡常数K(35℃)_______ K(90℃)(填“>”“<”或“=”)。
(1)工业上电解
(2)已知:过氧化氢不稳定,受热容易分解。工业上利用过硫酸铵制备过氧化氢的一种方法如图。

①过氧化氢的电子式为
②写出
③在上流程图中,“操作”的名称为
(3)氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理。

已知“反应2”为

①“反应1”的离子方程式为
②图中a、b点的反应速率:v(a正)
③平衡常数K(35℃)
21-22高三上·天津·期末


